A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H
+浓度之比是
10-4:1
10-4:1
.
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)
2溶液反应的离子方程式
Ba2++HCO3-+OH-═BaCO3↓+H2O
Ba2++HCO3-+OH-═BaCO3↓+H2O
.
(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
C
C
.
A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C
2(g)+3A
2(g)

2CA
3(g)
△H=-92.4kJ?mol
-1.反应达到平衡后,测得容器中含有C
2 0.5mol,A
2 0.2mol,CA
3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
BC
BC
:
A.C
2 0.6mol,A
2 0.5mol,CA
3 0mol
B.C
2 0mol,A
2 0mol,CA
3 1.2mol
C.C
2 0.6mol/L,A
2 0.5mol/L,CA
3 0.2mol/L
②求算此平衡体系的平衡常数K=
10
10
;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC
2,平衡将
逆向
逆向
(填“正向”、“逆向”或“不”)移动.理由是
原平衡体系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,当加入N
2,体系瞬间有分子0.9mol+0.18ml=1.08mol,瞬间总体积为1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移动
原平衡体系中,1.0L容器中含有分子0.5mol+0.2mol+0.2mol=0.9mol,当加入N
2,体系瞬间有分子0.9mol+0.18ml=1.08mol,瞬间总体积为1.08×
=1.2L,所以:Q=
=
=10.59>10,平衡逆向移动
.
④已知0.4mol 液态C
2 A
4与足量的液态双氧水反应,生成C
2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ?mol-1
.

 2CA3(g)
2CA3(g)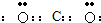
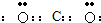
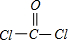
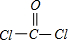
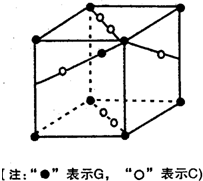 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质] [化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.
[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.