
| A. | H+、AlO2-、CO32- | B. | K+、Ba2+、SO42- | C. | NH4+、OH-、NO3- | D. | Fe3+、NO3-、Cl- |
分析 A.氢离子与偏铝酸根离子、碳酸根离子反应;
B.钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.铵根离子与氢氧根离子反应;
D.三种离子之间不反应,能够共存.
解答 解:A.H+与AlO2-、CO32-发生反应,在溶液中不能大量共存,故A错误;
B.Ba2+、SO42-之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故B错误;
C.NH4+、OH-之间发生反应,在溶液中不能大量共存,故C错误;
D.Fe3+、NO3-、Cl-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
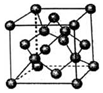 五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:
五种短周期元素X、Y、Z、W、Q的原子序数依次增.X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| W | Y | Z |
| A. | X、Y和氢三种元素形成的化合物中可能既有离子键、又有共价键 | |
| B. | Y的氧化物的通入过量BaCl2溶液中一定会产生白色沉淀 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
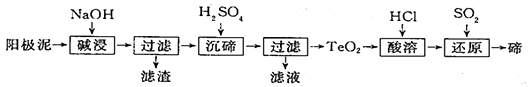
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液蒸干后灼烧得不到无水氯化铝 | |
| B. | 氯化铁溶液常用作制印刷电路板的腐蚀剂 | |
| C. | 常用热的纯碱溶液除去油污 | |
| D. | 长期施用硫酸铵易使土壤酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(l)△H<-867.0 KJ•mol-1 | |
| B. | 若增加甲烷的用量,平衡后体系中CO2的百分含量不一定升高 | |
| C. | 使用催化剂,可以降低反应的活化能,减少反应所放出的热量 | |
| D. | 标准状况下4.48 L CH4参加反应,转移电子数为1.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
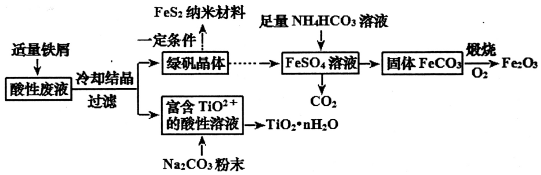
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用铂丝蘸取溶液X进行焰色反应实验 | 火焰呈黄色 | 溶液X一定是钠盐溶液 |
| B | 将Cl2通入石蕊试液中 | 溶液先变红后褪色 | Cl2具有漂白性 |
| C | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
| D | 向FeBr2溶液中加入少量氯水,再加 CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
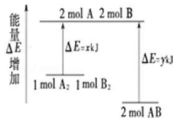
| A. | 该反应是吸热反应 | |
| B. | 断裂 1molA-A 键和 1mol B-B 键放出 xkJ 能量 | |
| C. | 断裂 2molA-B 键需要吸收 y kJ 的能量 | |
| D. | 1molA2和 1molB2 的总能量低于 2molAB 的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com