
| A、将氧化铝溶于水 |
| B、将氧化铝先溶于盐酸中,之后滴加氨水 |
| C、将氧化铝溶于盐酸中,之后滴加氢氧化钠溶液 |
| D、将氧化铝溶于氢氧化钾 |


科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ①②③ | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH<7 |
| A、HA的电离方程式为:HA?H++A- |
| B、不考虑其他组的实验结果,c≥0.2 |
| C、③组实验中,混合溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D、①组实验中,混合溶液中c(A-)=(0.1+10-9-10-5)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用新制氢氧化铜悬浊液无法鉴别葡萄糖和乙酸 |
| B、乙酸与乙醇可以发生酯化反应,又均可与碳酸氢钠溶液反应 |
| C、硫酸铵、硫酸铜和乙醇均能使蛋白质变性 |
| D、二氯甲烷不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B、混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C、混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol?L-1 |
| D、两溶液混合前,Na2SO3溶液中水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油通过分馏可直接得到乙烯 |
| B、乙烯、聚乙烯的最简式均为CH2,二者互为同分异构体 |
| C、可用氢氧化钠溶液来区别乙醇和乙酸 |
| D、乙醇、乙酸和乙酸乙酯都能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
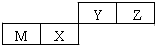
| A、原子半径Z>Y |
| B、X的最简单气态氢化物的热稳定性比Z的小 |
| C、Y的最高价氧化物对应水化物的酸性比X的弱 |
| D、M的最高价氧化物对应水化物不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高吸水性树脂属于功能高分子材料 |
| B、SiC、Al2O3的熔点很高,可用作高温结构陶瓷 |
| C、光导纤维、合成纤维和人造纤维都是有机高分子化合物 |
| D、合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com