
在密闭容器中的一定量混合气体发生反应: xA(g)+yB(g) zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断错误的是()
zC(g),平衡时测得A的浓度0.50mol/L,保持温度不变,将容器的容积大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol/L。下列有关判断错误的是()
A.x+y<z B.平衡向逆反应方向移动 C.B的转化率降低 D.C的体积分数下降
科目:高中化学 来源: 题型:
苯在催化剂存在下与液溴反应,而苯酚与溴水反应不用加热也不需催化剂,原因是( )
A.苯环与羟基相互影响,使苯环上氢原子活泼了。
B.苯环与羟基相互影响,使羟基上氢原子活泼了。
C.羟基影响了苯环,使苯环上的氢原子活泼了。
D.苯环影响了羟基,使羟基上的氢原子变得活泼了。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A常用作烟道气的警告剂,也可以做橡胶硫化促进剂、鞣剂等。一定条件下它可发生下图转化。已知E为高分子化合物。
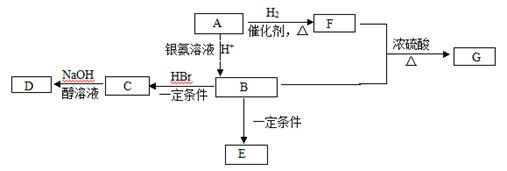
(1) 7.0 g有机物A完全燃烧可产生0.4 mol CO2和5.4 g H2O,经测定A分子含有甲基,所有的碳原子在一条碳链上,其蒸气对氢气的相对密度是35,A的结构简式为 。
(2)F中所含官能团的名称是 ,具有此官能团的F的同分异构体的数目有 种。
(3)B→C的反应类型为 ,C→D的反应类型为 。
(4)写出F+B→G的化学方程式 。
(5)下列关于B的说法正确的是 (填字母)。
A.不能使酸性高锰酸钾溶液褪色
B.可以与金属钠生成氢气
C.可以与碳酸钠反应
D.所有的原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业制氢气的一个重要反应是:CO(g)+H2O(g) CO2(g)+ H2(g)
CO2(g)+ H2(g)
已知在25℃时:(1)C(石墨)+1/2O2(g)=CO(g) ΔH1=—111kJ/mol
(2)H2(g)+1/2O2(g)=H2O(g) ΔH2=—242kJ/mol
(3)C(石墨)+O2(g)=CO2(g) ΔH3=—394kJ/mol
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热 。
(2)已知上述反应在427℃ 时的平衡常数是9.4。如果反应开始时,一氧化碳和水蒸气的浓度都是0.01 mol/L,计算一氧化碳在此反应条件下的转化率 。(保留3位有效数字)。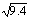 ≈3.07。
≈3.07。
(3)对于化学反应,速率也是研究的重要内容。在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa) ,并在一定温度下使其发生反应:H2(g)+I2(g)  2HI(g) ΔH<0。达到平衡后,以下能加快反应速率的是( )
2HI(g) ΔH<0。达到平衡后,以下能加快反应速率的是( )
①保持容器容积不变,向其中加入1mol H2。
②保持容器容积不变,向其中加入1mol N2(N2不参加反应)。
③保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应)。
④保持容器内气体压强不变,向其中加入1mol H2和1mol I2。
⑤提高起始的反应温度。
(4)2.0 mol PCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g) PCl5(g)。达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)。达平衡时,PCl5为0.40mol,如果此时移走1.0 mol PCl3和0.5molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.4 mol B.0.2 mol C.小于0.2 mol D.大于0.2 mol,小于0.4 mol
(5)已知25℃下,醋酸溶液中存在下述关系: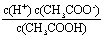 =1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。若醋酸的起始浓度为0.010 mol/L,平衡时c(H+)= . (
=1.75×10-5其中的数值是该温度下醋酸的电离平衡常数。若醋酸的起始浓度为0.010 mol/L,平衡时c(H+)= . (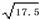 ≈4.18)
≈4.18)
(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010 mol/L)
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填<、>、=), 离子反应总方程式为 。
向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的pH 7(填<、>、=), 离子反应总方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成 +2价?写出有关反应的化学方程式或离子方程式。
+2价?写出有关反应的化学方程式或离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
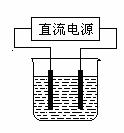 (1)电解饱和食盐水的化学方程式为 。
(1)电解饱和食盐水的化学方程式为 。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2. 24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70,lg2==0.30)
①理论上,电解后溶液的pH= 。
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是氯气和氢氧化钠溶液反应,写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com