
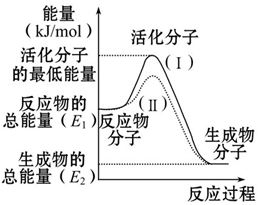
·ÖĪö £Ø1£©¢ŚÖŠĒāĄė×ÓŅÖÖĘļ§øłĄė×ÓĖ®½ā£¬¢ŪÖŠļ§øłĄė×ÓÓė“×ĖįøłĄė×ÓĻą»„“Ł½ųĖ®½ā£»
£Ø2£©¢ŁĪŖÖŠŠŌ£¬¢ŚĪŖĖįŠŌ£¬¢Ū¢Ü¾łĻŌ¼īŠŌ£¬ĒŅ¢ŪµÄĖ®½ā³Ģ¶Č“ó£»
£Ø3£©µČĢå»ż”¢ĪļÖŹµÄĮæÅضČĻąĶ¬Ź±£¬¢ŚÖŠĒāĄė×ÓĪļÖŹµÄĮæ×ī“󣬢Ł¢ŪÖŠĖįµÄĪļÖŹµÄĮæĻąĶ¬£»
£Ø4£©CH3COONaĪŖĒæ¼īČõĖįŃĪ£¬Ė®½āĻŌ¼īŠŌ£»
£Ø5£©»ģŗĻŗóČÜŅŗ³ŹÖŠŠŌ£¬Ōņ10”Į10-a=1”Į10b-14£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗ£Ø1£©¢ŚÖŠĒāĄė×ÓŅÖÖĘļ§øłĄė×ÓĖ®½ā£¬¢ŪÖŠļ§øłĄė×ÓÓė“×ĖįøłĄė×ÓĻą»„“Ł½ųĖ®½ā£¬ŌņµČÅØ¶ČŹ±c£ØNH4+£©ÓÉŠ”µ½“óµÄĖ³ŠņŹĒ¢Ū¢Ł¢Ś£¬¹Ź“š°øĪŖ£ŗ¢Ū¢Ł¢Ś£»
£Ø2£©¢ŁĪŖÖŠŠŌ£¬¢ŚĪŖĖįŠŌ£¬¢Ū¢Ü¾łĻŌ¼īŠŌ£¬ĒŅ¢ŪµÄĖ®½ā³Ģ¶Č“󣬼īŠŌŌ½Ē棬pHŌ½“ó£¬ŌņÖŠpHÓɓ󵽊”µÄĖ³ŠņŹĒ¢Ū¢Ü¢Ł¢Ś£¬¹Ź“š°øĪŖ£ŗ¢Ū¢Ü¢Ł¢Ś£»
£Ø3£©µČĢå»ż”¢ĪļÖŹµÄĮæÅضČĻąĶ¬Ź±£¬¢ŚÖŠĒāĄė×ÓĪļÖŹµÄĮæ×ī“󣬢Ł¢ŪÖŠĖįµÄĪļÖŹµÄĮæĻąĶ¬£¬ŌŚĻąĶ¬µÄĢõ¼žĻĀ£¬²śÉśH2µÄĢå»ż·Ö±šĪŖV1”¢V2”¢V3£¬ĖüĆĒÓɓ󵽊”µÄĖ³ŠņŹĒV2£¾V1=V3£¬¹Ź“š°øĪŖ£ŗV2£¾V1=V3£»
£Ø4£©CH3COONaĪŖĒæ¼īČõĖįŃĪ£¬Ė®½āĻŌ¼īŠŌ£¬Ė®½āĄė×Ó·“Ó¦ĪŖCH3COO-+H2O?CH3COOH+OH-£¬¹Ź“š°øĪŖ£ŗ¼ī£»CH3COO-+H2O?CH3COOH+OH-£»
£Ø5£©»ģŗĻŗóČÜŅŗ³ŹÖŠŠŌ£¬ĒæĖįÖŠĒāĄė×ÓµÄĪļÖŹµÄĮæµČÓŚĒæ¼īÖŠĒāŃõøłĄė×ÓµÄĪļÖŹµÄĮ棬Ōņ10”Į10-a=1”Į10b-14£¬Ōņa+b=15»ņpH1+pH2=15£¬
¹Ź“š°øĪŖ£ŗa+b=15»ņpH1+pH2=15£®
µćĘĄ ±¾Ģāæ¼²éČõµē½āÖŹµÄµēĄė¼°Ėį¼ī»ģŗĻ£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕŃĪĄąĖ®½ā”¢Čõµē½āÖŹµÄµēĄė”¢Ėį¼ī»ģŗĻµÄ¼ĘĖćĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāČÜŅŗµÄÅØ¶Č”¢pHµÄ¹ŲĻµ£¬ĢāÄæÄŃ¶Č²»“ó£®


 ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ѧ¶ųÓÅŹīĘŚĻĪ½ÓÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
Happy holiday»¶ĄÖ¼ŁĘŚŹī¼Ł×÷Ņµ¹ć¶«ČĖĆń³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ×ī³£¼ūµÄĒā»ÆĪļµÄ·Šµć£ŗY£¾X£¾W£¾Z | |
| B£® | ¼ņµ„Ąė×Ó°ė¾¶£ŗW£¾X£¾Y£¾Z | |
| C£® | YÓėZÄÜŠĪ³É»Æѧ¼üĄąŠĶĶźČ«ĻąĶ¬µÄĮ½ÖÖ»ÆŗĻĪļ | |
| D£® | ZÓėWŠĪ³ÉµÄ³£¼ū»ÆŗĻĪļČÜÓŚĖ®ŗó£¬Ė®µÄµēĄė³Ģ¶Č±äŠ” |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ĒėČĻÕę¹Ū²ģČēĶ¼£¬Č»ŗó»Ų“šĪŹĢā£ŗ
ĒėČĻÕę¹Ū²ģČēĶ¼£¬Č»ŗó»Ų“šĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 9ÖÖ | B£® | 10ÖÖ | C£® | 11ÖÖ | D£® | 12ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĄūÓƶ”“ļ¶ūŠ§Ó¦æÉĒų·Öµ°°×ÖŹČÜŅŗÓėĘĻĢŃĢĒČÜŅŗ | |
| B£® | ½«±„ŗĶFeCl3ČÜŅŗµĪČė·ŠĖ®ÖŠ£¬½«¼ĢŠųÖó·ŠÖĮČÜŅŗ³ŹŗģŗÖÉ«¼“Éś³ÉĒāŃõ»ÆĢś½ŗĢå | |
| C£® | ÓĆ¹żĀĖ·ØæÉŅŌ³żČ„Fe£ØOH£©3½ŗĢåÖŠµÄFeCl3 | |
| D£® | Óƶ¹½¬ÖŠ¼ÓČėĮņĖįøĘÖʶ¹øÆ£¬ŹĒĄūÓĆĮĖ½ŗĢåµÄ¾Ū³ĮŠŌÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ÖĄėAl2O3ÓėFe2O3»ģŗĻĪļæÉŅŌ²ÉČ”¼ÓČė¹żĮæNaOHČÜŅŗ³ä·Ö·“Ó¦ŗ󣬹żĀĖ”¢Ļ“µÓ”¢øÉŌļ | |
| B£® | ÓĆ¹żĮæ°±Ė®³żČ„Fe3+ČÜŅŗÖŠµÄÉŁĮæAl3+ | |
| C£® | ½«Fe£ØOH£©3·ÅČė±ķĆęĆóÖŠ£¬¼ÓČė×ćĮæŃĪĖį£¬½«·“Ó¦ŗóµÄČÜŅŗ¼ÓČČÕōøÉ”¢×ĘÉÕµĆµ½Fe2O3 | |
| D£® | Al£ØOH£©3ÖŠ»ģÓŠMg£ØOH£©2¼ÓČė×ćĮæÉÕ¼īČÜŅŗ£¬³ä·Ö·“Ó¦¹żĀĖ£¬ĻņĀĖŅŗÖŠ¼ÓČė×ćĮæŃĪĖįŗó¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
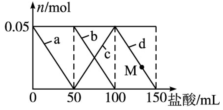 Ļņ100mLŗ¬Na2CO3”¢NaAlO2µÄ»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČė150mL 1mol•L-1HClČÜŅŗ£¬²āµĆČÜŅŗÖŠµÄij¼øÖÖĄė×ÓĪļÖŹµÄĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
Ļņ100mLŗ¬Na2CO3”¢NaAlO2µÄ»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČė150mL 1mol•L-1HClČÜŅŗ£¬²āµĆČÜŅŗÖŠµÄij¼øÖÖĄė×ÓĪļÖŹµÄĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | aĒśĻß±ķŹ¾µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAlO2-+H++H2OØTAl£ØOH£©3”ż | |
| B£® | bĒśĻß±ķŹ¾Ģ¼ĖįÄĘŗĶŃĪĖį·“Ó¦£¬dĒśĻß±ķŹ¾ĒāŃõ»ÆĀĮµÄČܽā | |
| C£® | MµćŹ±£¬ČÜŅŗÖŠ³ĮµķµÄÖŹĮæŠ”ÓŚ3.9 g | |
| D£® | Ō»ģŗĻČÜŅŗÖŠµÄNa2CO3ČÜŅŗµÄÅضČĪŖ1 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
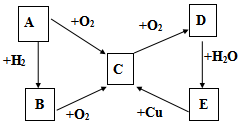 ŅŃÖŖA”¢B”¢C”¢D”¢EĪåÖÖĪļÖŹÓŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ¹ŲĻµ£Ø²æ·Ö·“Ó¦Īļ¼°·“Ó¦Ģõ¼žĪ“ĮŠ³ö£¬Čō½āĢāŹ±ŠčŅŖ£¬æÉ×÷ŗĻĄķ¼ŁÉč£©£¬ĒŅĪåÖÖĪļÖŹÖŠ¾łŗ¬ÓŠAŌŖĖŲ£®
ŅŃÖŖA”¢B”¢C”¢D”¢EĪåÖÖĪļÖŹÓŠČēĶ¼ĖłŹ¾µÄ×Ŗ»Æ¹ŲĻµ£Ø²æ·Ö·“Ó¦Īļ¼°·“Ó¦Ģõ¼žĪ“ĮŠ³ö£¬Čō½āĢāŹ±ŠčŅŖ£¬æÉ×÷ŗĻĄķ¼ŁÉč£©£¬ĒŅĪåÖÖĪļÖŹÖŠ¾łŗ¬ÓŠAŌŖĖŲ£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com