
【题目】如图为周期表的一部分,表中所列的字母分别代表一种化学元素。回答下列问题:
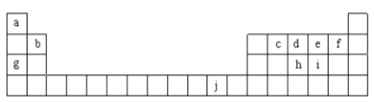
(1)f的基态原子核外电子排布式______。
(2)在c2a4分子中,c为______杂化,c与c间存在的共价键类型有______两种。
(3)ci2与ce2比较,沸点较高的是______(写分子式)。
(4)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液。深蓝色溶液中是由于存在______(写结构式)
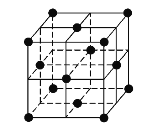
(5)j的金属晶体的晶胞如图所示,则一个晶胞中每个j原子周围与它最接近且距离相等的j共有的个数是______个,已知该元素的相对原子质量为64,单质晶体的密度为ρgcm-3,阿伏加德罗常数的值为NA,试求铜的金属半径为______pm(用含NA、ρ的表达式表达)。
【答案】1s22s22p5 sp2 σ 和π CS2 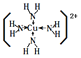 12
12 ![]()
【解析】
(1)f为F原子,核外有9个电子,基态原子核外电子排布式为1s22s22p5 ,故答案为:1s22s22p5 ;
(2)c为C,a为H,则c2a4为C2H4,乙烯为平面结构,分子中,c为sp2杂化,c与c间为碳碳双键,共价键类型有 σ 和π两种,
故答案为:sp2;σ 和π;
(3)c为C,i为S,e为O,则ci2与ce2分别为CS2与CO2,组成和结构相似的分子,相对分子质量越大,分子间作用力越大,沸点越高,所以沸点较高的是CS2,故答案为:CS2;
(4)j为Cu,将氨水滴入到硫酸铜溶液中,铜离子存在空轨道,和氨气分子通过形成配位键形成铜氨离子,所以深蓝色溶液中是由于存在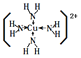 ,
,
故答案为: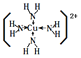 ;
;
(5)由晶胞结构示意图可知,铜的晶胞为面心立方最密堆积,配位数是12,即每个铜原子周围与它最接近且距离相等的铜原子共有12个;晶胞中顶点的原子属于该晶胞只有1/8,面心的原子属于该晶胞只有1/2,则该晶胞中所含原子数为8×1/8+6×1/2=4,取1mol晶胞,即有NA个晶胞,设晶胞边长为acm,1个晶胞中含有Cu的体积为V=a3cm3,则晶体密度为ρ=![]() g/cm3,根据几何关系,Cu的半径与晶胞边长之间关系为:
g/cm3,根据几何关系,Cu的半径与晶胞边长之间关系为:![]() =4r,所以a=2
=4r,所以a=2![]() r,则r=
r,则r=![]() 。
。
故答案为:12 ; ![]() 。
。


科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
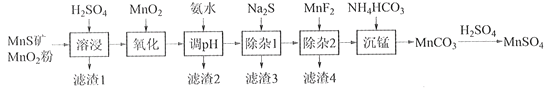
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:
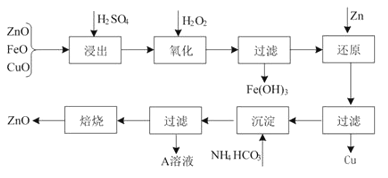
(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将Ⅰ阀关闭,Ⅱ阀打开,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是
①浓硫酸 ②饱和氯化钠溶液 ③NaOH溶液 ④饱和碳酸钠溶液 ⑤水

A. ①③ B. ②⑤ C. ②③⑤ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,不能表明反应: 2NO2(g)![]() 2NO(g)+O2(g) 已达平衡状态的是
2NO(g)+O2(g) 已达平衡状态的是
A. 容器中颜色不再改变 B. 混合气平均相对分子质量不再改变
C. 混合气密度不再改变 D. 单位时间内生成n mol O2的同时生成2n mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是
A.c=1 000Vρ/(17V+22 400)B.w=17c/(1000ρ)
C.w=17V/(17V+22 400)D.ρ=(17V+22 400)/(22.4+22.4V)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是
A. 用干燥洁净的玻璃棒蘸取![]() 溶液,点到置于表面皿的pH试纸上测pH
溶液,点到置于表面皿的pH试纸上测pH
B. 氢氧化钠固体或碱石灰既可与浓氨水作用制得氨气,也可用于干燥氨气
C. 双氧水不稳定,见光、遇热、遇大多数金属氧化物都会加快它的分解,但在碱性环境下分解较慢
D. 海带中提取碘的过程中,可用过量的氯气或双氧水氧化水溶液中的![]() ,得到碘单质
,得到碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g) △H=-359.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-556.0kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0kJ·mol-1
写出体现甲醇燃烧热的热化学方程式为________________________________。
(2)某温度时,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
①经过5 min后,反应达到平衡,此时转移电子6 mol。该反应的平衡常数为________。v(H2)=________ mol/(L·min)。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。
②在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
③下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com