
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
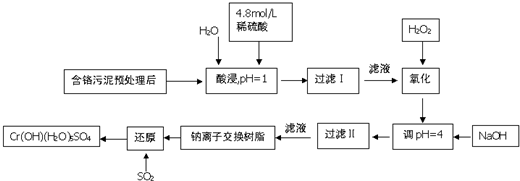
分析 含铬污泥酸浸后滤去不溶物,滤液中加入过氧化氢,由(2)可知过氧化氢将Cr3+氧化为Cr2O72-,此外将Fe2+氧化为Fe3+,再加入NaOH调节pH=4,使Fe3+转化为Fe(OH)3,过滤除去,滤液经过钠离子交换树脂后,被二氧化硫还原得到CrOH(H2O)5SO4,则钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+,
(1)酸浸是溶解物质为了提高浸取率,可以增大接触面积,延长浸取时间,升高温度,过滤后再向滤渣中加入硫酸(多次浸取)等;
(2)另外作用是将Fe2+氧化为Fe3+;
(3)过滤Ⅱ得到沉淀为氢氧化铁;
(4)钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+;
(5)反应中Cr元素化合价由+6价降低为+3价,S元素由+4价升高为+6价,根据电子转移守恒计算消耗SO2物的质量;
(6)①Fe为阳极,发生反应:Fe-2e-=Fe2+,得到还原性的Fe2+离子将还原Cr2O72-还原为Cr3+,阴极发生反应:2H++2e-=H2↑,溶液中氢离子浓度减小,溶液pH增大,Cr3+、Fe3+转化为Cr(OH)3和Fe(OH)3沉淀除去;
②根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)、Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)计算.
解答 解:含铬污泥酸浸后滤去不溶物,滤液中加入过氧化氢,由(2)可知过氧化氢将Cr3+氧化为Cr2O72-,此外将Fe2+氧化为Fe3+,再加入NaOH调节pH=4,使Fe3+转化为Fe(OH)3,过滤除去,滤液经过钠离子交换树脂后,被二氧化硫还原得到CrOH(H2O)5SO4,则钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+,
(1)酸浸是溶解物质为了提高浸取率,可以将污泥粉碎、进行搅拌,以增大接触面积,可以延长浸取时间,可以升高温度,也可以过滤后再向滤渣中加入硫酸,进行多次浸取,合并浸取液,
故答案为:ABC;
(2)另外作用是将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)由上述分析可知,过滤Ⅱ产生的沉淀为Fe(OH)3,故答案为:Fe(OH)3;
(4)钠离子交换膜除去溶液中Al3+、Ca2+、Mg2+,故被交换的离子为:Al3+、Ca2+、Mg2+,故答案为:Al3+、Ca2+、Mg2+;
(5)反应中Cr元素化合价由+6价降低为+3价,S元素由+4价升高为+6价,根据电子转移守恒,消耗SO2物的质量为$\frac{1mol×(6-3)}{6-4}$=1.5mol,故答案为:1.5mol;
(6)①Fe为阳极,发生反应:Fe-2e-=Fe2+,得到还原性的Fe2+离子将还原Cr2O72-还原为Cr3+,阴极发生反应:2H++2e-=H2↑,溶液中氢离子浓度减小,溶液pH增大,Cr3+、Fe3+转化为Cr(OH)3和Fe(OH)3沉淀除去,铁电极与直流电源正极相连,加入适量NaCl的目的是增大溶液导电能力,
故答案为:正极;增大溶液导电能力;
②Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.0×10-13×c3(OH-)=4.0×10-38,而Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.0×10-31,联立解得:c(Cr3+)=3.0×10-6mol/L,
故答案为:3.0×10-6mol/L.
点评 本题以化学工艺流程为载体,考查物质分离提纯、对原理与操作的分析评价、信息获取与迁移运用、氧化还原反应计算、电解原理、溶度积有关计算等,题目综合性强,侧重考查学生分析解决问题的能力,是高考题的常见形式,关键是理解工艺流程,难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| C | Cu | Zn | 加入足量稀盐酸,充分反应后过滤,洗涤,干燥 |
| D | FeCl2溶液 | CuCl2 | 加入足量铁粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | 水玻璃是纯净物,可用于生产黏合剂和防火剂 | |
| C. | 某硅酸盐的化学式为KAlSi3O8,可用K2O.Al2 O3.6SiO2表示 | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:HClO4>H2SO4>H3PO4 | |
| C. | 热稳定性:碘化氢>溴化氢>氯化氢 | |
| D. | 最高正化合价:氯>硫>磷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与二氧化碳反应中电子转移数为0.2NA | |
| B. | 一定量的C02为0.1NA | |
| C. | 18.4g固体物质为0.lmol Na2C03和0.05molNa202的混合物 | |
| D. | 一定量的Na202为0.lmol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| C. | 侯氏制碱法的最终产品是小苏打 | |
| D. | 明矾可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
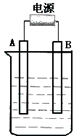 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com