
| A. | 9 种 | B. | 10种 | C. | 11 种 | D. | 12 种 |
分析 有机物C4H9C1O的同分异构体中能与Na反应放出氢气,说明其分子中含有羟基,先写出丁醇的同分异构体,然后根据丁醇中等效H原子判断其一氯代物即可(注意不考虑羟基与氯原子在同一个碳原子上).
解答 解:有机物C4H9C1O的同分异构体中能与Na反应放出氢气,说明其分子中含有羟基,该有机物可以看作Cl原子取代丁醇中氢原子形成的,
丁醇的同分异构体有:CH3CH2CH2CH2OH、CH3CHOHCH2CH3、(CH3)3COH、CH3(CH3)CHCH2OH,
CH3CH2CH2CH2OH分子的烃基中含有4种等效H原子,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有3种;
CH3CHOHCH2CH3分子的烃基中含有4种H原子,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有3种;
(CH3)3COH分子中的烃基中含有1种H原子,其一氯代物有1种;
CH3(CH3)CHCH2OH分子的烃基上含有3种等效H,不考虑羟基与氯原子在同一个碳原子上时,其一氯代物有2种;
根据分析可知,有机物C4H9C1O的同分异构体中能与Na反应放出氢气的共有:3+3+1+2=9;
故选A.
点评 本题考查了同分异构体的书写,题目难度不大,明确同分异构体的书写原则为解答关键,注意掌握常见有机物组成与结构,试题培养了学生的分析能力及逻辑推理能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
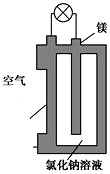 镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景.如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )| A. | 该电池的总反应为2Mg+O2═2MgO | |
| B. | 反应生成O2-,该离子有正极移向负极 | |
| C. | Cl-在阳极失去电子生成Cl2 | |
| D. | 正极反应式为O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CHCH2OH 能发生加成反应、取代反应、氧化反应等 | |
| B. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| C. | CH3CH═CHCH3分子中所有原子在同一个平面上 | |
| D. | 结构为…-CH=CH-CH═CH-CH═CH-CH=CH-…的高分子化合物,其单体是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5)(6) | B. | (3)(4)(5) | C. | (2)(3)(5)(6) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与水反应形成的二元酸的分子式是H2CO3 | |
| B. | Y是一种非极性分子,能与水反应生成强酸 | |
| C. | Y+A→X+Z的化学方程式为2 P+5SO3=5SO2+P2O5 | |
| D. | Z在加热时与水反应的产物名称是磷酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
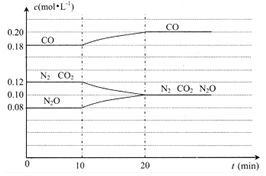 汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.
汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应.| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(N2O) | n(CO) | n(CO2) | ||
| ① | 400 | 0.20 | 0.30 | 0.14 |
| ② | 500 | 0.10 | 0.40 | 0.080 |
| ③ | 500 | 0.30 | 0.20 | A |
| ④ | 600 | 0.60 | 0.40 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子的发现:道尔顿的原子结构模型 | |
| B. | α粒子的散射:汤姆生原子结构模型 | |
| C. | α粒子散射:玻尔原子结构模型 | |
| D. | 氢原子光谱:玻尔原子结构模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL0.1mol/LCH3COONa溶液与 10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>?c(Cl-)>c(CH3COOH)>?c(H+) | |
| B. | 0.1mol/L Na2C2O4溶液与 0.1mol/L HCl 溶液等体积混合,所得溶液中:2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) | |
| C. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| D. | 将amol/L氨水与0.01mol/L 盐酸等体积混合,若反应完全时溶液中 c(NH4+)=c(Cl-),则NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列溶液中,物质的量浓度最大的是( )
A.1 L H2SO4溶液中含98 g H2SO4 B.0.5 L含49 g H2SO4的溶液
C.98 g H2SO4溶于水配成2 L溶液 D.0.1 L含24.5 g H2SO4的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com