
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |
| c[Co(H2O)62+]c4(Cl-) |
| c(CoCl2-) |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�






�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧ����ʽ | ƽ�ⳣ��K |
| F2+H22HF | 6.5��1095 |
| Cl2+H22HCl | 2.6��1033 |
| Br2+H22HBr | 1.9��1019 |
| I2+H22HI | 8.7��102 |
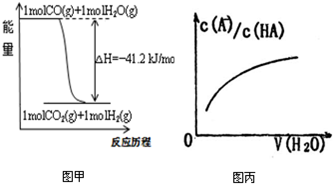
| A����֪CO��ȼ����283kJ/mol��2H2��g��+O2��g��=2H2O��g������H=-483.6kJ/mol����ͼ�ױ�ʾCO��H2O��g������CO2��H2�������仯 | ||
| B��ij�¶��£�pH=11��NH3?H2O��pH=1������������Ϻ����ǻ�Ϻ���Һ����ı仯��ǡ����ȫ��Ӧ����Ӧ�����Һ��NH4+��NH3?H2O��NH3��������ƽ��Ũ��֮��Ϊ0.05mol?L��1 | ||
| C���ڳ����£�X2��g����H2��Ӧ����HX��ƽ�ⳣ���������ʾ��������K�ı仯���Ϳ���˵������ͬ�����£�ƽ��ʱX2����F2��I2����ת�������ͣ���X2��H2��Ӧ�ľ��ҳ̶����� | ||
D��ͼ�������߱�ʾ������������HA��ϡ��Һ�м�ˮϡ�����У�
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������������Ŀ���ʴ����Խ��Խ�ܵ����ǵ�����������Ҫ����������������ͭ��̼��Ԫ������ɵĺϽ�
�������������Ŀ���ʴ����Խ��Խ�ܵ����ǵ�����������Ҫ����������������ͭ��̼��Ԫ������ɵĺϽ�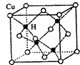 ��ʾ����CuH���ܶ�Ϊd g/cm3�������ӵ�������ֵΪNA����þ����ı߳�Ϊ
��ʾ����CuH���ܶ�Ϊd g/cm3�������ӵ�������ֵΪNA����þ����ı߳�Ϊ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 [��ѧ--ѡ�����ʽṹ������]�������������Ŀ���ʴ����Խ��Խ�ܵ����ǵ�����������Ҫ����������������ͭ��̼��Ԫ������ɵĺϽ�
[��ѧ--ѡ�����ʽṹ������]�������������Ŀ���ʴ����Խ��Խ�ܵ����ǵ�����������Ҫ����������������ͭ��̼��Ԫ������ɵĺϽ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�
ͨ��ú��������Һ����ʹ̼���仯������Թ㷺Ӧ�ã�| t/min | 0 | 1 | 2 | 3 | 4 |
| n��H2O��/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n��CO��/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
| ����/Ҷ���� |
| ||
| �� |
| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com