
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
分析 A.在水溶液中或熔融状态下能导电的化合物是电解质;
B.向醋酸溶液中加入少量醋酸溶液,如果二者浓度相同,则不影响醋酸电离;
C.弱电解质的电离是吸热反应,升高温度平衡向吸热方向移动;
D.电解质溶液导电性与离子浓度及电荷成正比.
解答 解:A.在水溶液中或熔融状态下能导电的化合物是电解质,氯水、氨水导电的原因分别是HCl和HClO、NH3.H2O电离出自由移动的离子而导电,但氯气既不是电解质也不是非电解质,氨气是非电解质,故A错误;
B.向醋酸溶液中加入少量醋酸溶液,如果二者浓度相同,则不影响醋酸电离,则醋酸电离程度不变,故B错误;
C.弱电解质的电离是吸热反应,升高温度平衡向吸热方向移动,所以升高温度促进弱电解质电离,故C正确;
D.电解质溶液导电性与离子浓度及电荷成正比,与电解质强弱无关,所以强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,故D错误;
故选C.
点评 本题考查弱电解质的电离、电解质概念、弱电解质电离影响因素等知识点,侧重考查学生分析判断能力,明确弱电解质电离特点及其影响因素是解本题关键,易错选项是BD,注意强弱电解质的根本区别是电离程度,电解质溶液导电性强弱与电解质强弱及溶解性无关,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 8:7 | B. | 5:7 | C. | 7:8 | D. | 7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤④①② | B. | ③④②①⑤ | C. | ④①②⑤③ | D. | ③②④①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH=4 | |
| B. | 升高温度,溶液的pH增大 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 若要使HA的电离平衡向左移动且溶液的pH值减小,可以在溶液中通入HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
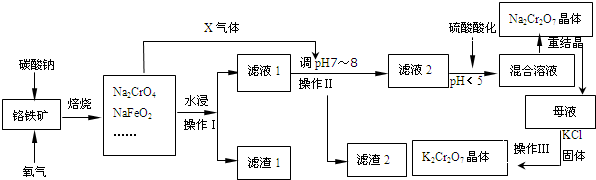
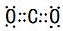 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-?CH3COO-+H2O | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | S2-+H2O?HS-+OH- | D. | NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
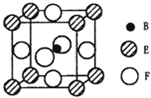 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com