


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
查看答案和解析>>
科目:高中化学 来源: 题型:
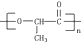 由一种单体缩聚而成的,该单体的结构简式为
由一种单体缩聚而成的,该单体的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
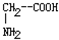 和丙氨酸
和丙氨酸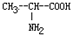 混合反应,生成的“二肽”最多为
混合反应,生成的“二肽”最多为查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾可用来净水 |
| B、一束平行光线照射蛋白质溶液时,从一侧可以看到光亮的通路 |
| C、FeCl3溶液中滴入NaOH溶液,出现红褐色沉淀 |
| D、Al(OH)3或Fe(OH)3胶体可以吸附水中的悬浮颗粒而沉降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com