
| A. | 氯分子的电子式: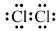 | |
| B. | 氯离子(Cl-)的结构示意图: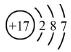 | |
| C. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}Cl$ | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
分析 A.氯气分子中含有1个Cl-Cl键,氯原子最外层都得到8电子稳定结构;
B.氯离子的最外层得到8电子稳定结构;
C.质量数=质子数+中子数,该氯原子的质量数为37;
D.氯乙烯分子中含有碳碳双键,H3C-CH2Cl为氯乙烷.
解答 解:A.氯分子中每个氯原子最外层都满足8电子稳定结构,其电子式为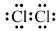 ,故A正确;
,故A正确;
B.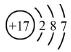 为氯原子结构示意图,氯离子的核外电子总数为18,最外层满足8电子稳定结构,其正确的离子结构示意图为:
为氯原子结构示意图,氯离子的核外电子总数为18,最外层满足8电子稳定结构,其正确的离子结构示意图为: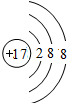 ,故B错误;
,故B错误;
C.质子数为17、中子数为20的氯原子的质量数为37,其正确的表示方法为:1737Cl,故C错误;
D.氯乙烯分子中含有1个碳碳双键,其正确的结构简式为:H2C=CH2Cl,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、电子式、结构简式、元素符号等知识,明确常见化学用语的书写原则为解答结构,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
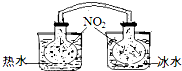 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、NO3-、Na+ | B. | CO32-、NH4+、Cl-、Ca2+ | ||
| C. | 中性溶液中:Fe3+、Cl-、NO3-、Na+ | D. | Fe3+、Cl-、NO3-、Na+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ/mol) | 414 | 489 | 565 | 155[ |
| A. | -1940kJ•mol-1 | B. | +1940kJ•mol-1 | C. | -485kJ•mol-1 | D. | +485kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为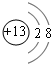 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com