
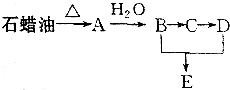 某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空:
某课外小组以石蜡为原料进行如图所示转化关系的实验探究,其中E具有果香味,且分子中含4个碳原子.试填空: CH3COOCH2CH3+H2O,反应类型为酯化反应.
CH3COOCH2CH3+H2O,反应类型为酯化反应. 分析 E具有果香味,且分子中含4个碳原子,说明E是含有4个C原子的酯,B能转化为D,则B、C、D中碳原子个数相等为2,则B、C、D、E结构简式为CH2CH2OH、CH3CHO、CH3COOH、CH3COOCH2CH3,A和水发生加成反应生成乙醇,则A为CH2=CH2,据此分析解答.
解答 解:E具有果香味,且分子中含4个碳原子,说明E是含有4个C原子的酯,B能转化为D,则B、C、D中碳原子个数相等为2,则B、C、D、E结构简式为CH2CH2OH、CH3CHO、CH3COOH、CH3COOCH2CH3,A和水发生加成反应生成乙醇,则A为CH2=CH2,
(1)B、D分别为CH3CHO、CH3COOCH2CH3,则B、D中官能团的名称分别是醛基、酯基,故答案为:醛基;酯基;
(2)A是乙烯、B是乙醇,乙烯和水在一定条件下发生加成反应生成乙醇,所以A→B的化学方程式为 CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,反应类型为加成反应,故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;加成反应;
(3)B是乙醇、D是乙酸,乙醇和乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,B+D→E的化学方程式为CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O,反应类型为酯化反应,故答案为:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,反应类型为酯化反应,故答案为:CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O;酯化反应.
CH3COOCH2CH3+H2O;酯化反应.
点评 本题考查有机物推断,为高频考点,涉及乙醇、乙烯、乙醛、乙酸、乙酸乙酯之间的转化,明确常见有机物官能团及其性质、反应条件、常见反应类型等即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
 直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )
直接甲醇燃料电池以其供电量大、持续时间长而极具发展前景,其工作原理如图所示,下列关于它的说法正确的是( )| A. | 电子经外电路自b极流向a极 | |
| B. | b极的电极半反应为O2+4e-+4H+=2H2O | |
| C. | 质子交换膜中的H+流向a极 | |
| D. | 以此电池供电,电解CuSO4溶液,理论上每生成0.1molCu最少需要氧气1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 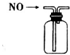 装置可收集NO气体 | |
| B. |  装置可吸收多余氨气且能防止倒吸 | |
| C. |  装置可实现反应:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | |
| D. | 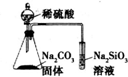 装置可证明非金属性:S>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )
控制适当的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池,下列判断正确的是( )| A. | 反应开始时,电子从甲池电极移向乙池电极 | |
| B. | 平衡时电流表指针为零,两池溶液颜色相同 | |
| C. | 平衡时Fe3+氧化性比I2强 | |
| D. | 平衡时向甲池中溶入FeCl2固体后,乙池的石墨电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:乙>丙>丁 | |
| B. | 单质的还原性:丁>丙>甲 | |
| C. | 乙、丙、丁的最髙价氧化物对应的水化物能相互反应 | |
| D. | 甲、乙、丙的氧化物均为共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com