
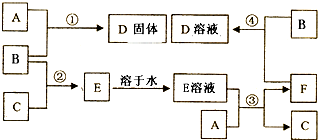
分析 单质B为黄绿色气体,可知B为Cl2,E溶液是无色的是BC气体反应生成,可以合A固体方式反应生成F合气体C,则判断E为HCl,C为H2,A合E溶液反应得到F和Cl2发生反应生成D,A和Cl2反应生成D固体,说明A为变价元素,根据元素守恒可知,推断A为Fe,D为FeCl3,结合转化关系可知,单质C为H2,E为HCl,F为FeCl2,据此解答.
解答 解:单质B为黄绿色气体,可知B为Cl2,E溶液是无色的是BC气体反应生成,可以合A固体方式反应生成F合气体C,则判断E为HCl,C为H2,A合E溶液反应得到F和Cl2发生反应生成D,A和Cl2反应生成D固体,说明A为变价元素,根据元素守恒可知,推断A为Fe,D为FeCl3,结合转化关系可知,单质C为H2,E为HCl,F为FeCl2,
(1)单质B为黄绿色气体,可知B为Cl2;F与氨气反应生成白色沉淀G、G在空气中变为红褐色沉淀,则红褐色沉淀为Fe(OH)3,G为Fe(OH)2,根据元素守恒可知,单质A为Fe,结合转化关系可知,单质C为H2,E为HCl,F为FeCl2,D为FeCl3,
故答案为:Fe;Cl2;H2;
(2)反应③的化学方程式为:Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(3)反应④的离子方程式为:2Fe2++Cl2=2Cl-+2Fe3+,故答案为:2Fe2++Cl2=2Cl-+2Fe3+;
(4)实验室制取B为氯气,利用二氧化锰和浓盐酸加热反应制备,反应的反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2 H2O;
(5)实验室检验D溶液中阳离子为Fe3+,检验的试剂是硫氰化钾溶液,遇到铁离子形成血红色溶液,
故答案为:硫氰化钾溶液,溶液变红;
点评 本题考查无机物的推断,题目难度中等,物质的颜色是推断突破口,注意对元素化合物性质的掌握.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①⑤⑥ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:K+、Al3+、NO3-、HCO3- | |
| B. | 常温下c(H+)/c(OH-)=1×10-12的溶液:Na+、K+、AlO2-、CO32- | |
| C. | 强酸性溶液:NH4+、Na+、SO32-、NO3- | |
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
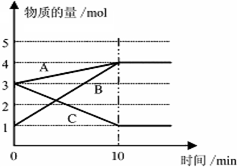 将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
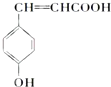 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 热稳定性:正丁烷<异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为: 2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)△H=-1560.8KJ/mol | |
| C. | 正戊烷的燃烧热不超过3530 KJ/mol | |
| D. | 相同质量的烷烃,碳的质量分数越大,完全燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
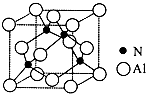 Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.
Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.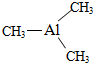 ,则其
,则其查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com