

 ,该反应属于消去反应.
,该反应属于消去反应. .
. .
. 和2个-CH3;
和2个-CH3; 的变化).
的变化). .
.
分析 B与溴发生加成反应生成C为 ,C发生卤代烃的消去反应得到D为
,C发生卤代烃的消去反应得到D为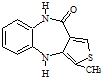 ,D发生取代反应生成E为
,D发生取代反应生成E为 ,E再发生取代反应得到F.
,E再发生取代反应得到F.
(1)根据A的结构简式可知,含有的含氧官能团有酯基、羰基;
(2)步骤③发生卤代烃的消去反应;
(3)D发生取代反应得到E;
(4)A的同分异构体同时满足下列条件:
①含有 和2个-CH3,②能发生银镜反应和水解反应(不考虑
和2个-CH3,②能发生银镜反应和水解反应(不考虑 的变化),说明还含有醛基与酯基,则含有-OOCH,可以看做
的变化),说明还含有醛基与酯基,则含有-OOCH,可以看做 中H原子被2个-CH3、-OOCH取代,当2个-CH3处于同一碳原子上,有3种位置,对应的-OOCH分别有2种位置,当2个-CH3处于不同碳原子上,有3种组合,对应的-OOCH分别有3种位置;
中H原子被2个-CH3、-OOCH取代,当2个-CH3处于同一碳原子上,有3种位置,对应的-OOCH分别有2种位置,当2个-CH3处于不同碳原子上,有3种组合,对应的-OOCH分别有3种位置;
(5)苯发生硝化反应得到硝基苯,硝基苯还原得到苯胺,在与ClCH2COCl发生取代反应,最后与(C2H4)2NH发生取代反应得到 .
.
解答 解:B与溴发生加成反应生成C为 ,C发生卤代烃的消去反应得到D为
,C发生卤代烃的消去反应得到D为 ,D发生取代反应生成E为
,D发生取代反应生成E为 ,E再发生取代反应得到F.
,E再发生取代反应得到F.
(1)根据A的结构简式可知,含有的含氧官能团有酯基、羰基,
故答案为:酯基、羰基;
(2)步骤③发生卤代烃的消去反应,反应方程式为:
故答案为:
(3)D发生取代反应得到E,E的结构简式为: ,
,
故答案为: ;
;
(4)A的同分异构体同时满足下列条件:
①含有 和2个-CH3,②能发生银镜反应和水解反应(不考虑
和2个-CH3,②能发生银镜反应和水解反应(不考虑 的变化),说明还含有醛基与酯基,则含有-OOCH,可以看做
的变化),说明还含有醛基与酯基,则含有-OOCH,可以看做 中H原子被2个-CH3、-OOCH取代,当2个-CH3处于同一碳原子上,有3种位置,对应的-OOCH分别有2种位置,当2个-CH3处于不同碳原子上,有3种组合,对应的-OOCH分别有3种位置,故符合条件的同分异构体共有15种,其中一种的结构简式为:
中H原子被2个-CH3、-OOCH取代,当2个-CH3处于同一碳原子上,有3种位置,对应的-OOCH分别有2种位置,当2个-CH3处于不同碳原子上,有3种组合,对应的-OOCH分别有3种位置,故符合条件的同分异构体共有15种,其中一种的结构简式为:
故答案为:15;
(5)苯发生硝化反应得到硝基苯,硝基苯还原得到苯胺,在与ClCH2COCl发生取代反应,最后与(C2H4)2NH发生取代反应得到 ,合成路线流程图为:
,合成路线流程图为: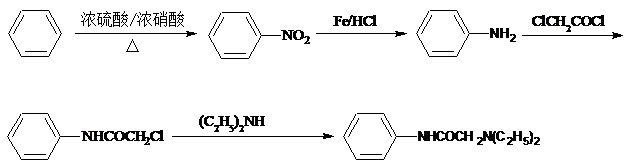
故答案为: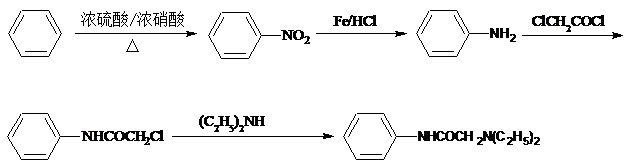
点评 本题考查有机物的推断与合成,充分根据有机物的结构进行分析,(4)中同分异构体书写为易错点,注意利用定二移一法解答,侧重考查学生对信息的获取与迁移应用,是高考热点题型.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中存在的电子总数为12NA | |
| B. | 标准状况下,22.4LHF的物质的量为1mol | |
| C. | 铅蓄电池电解氯化钠溶液,得到标况下22.4L氢气,理论上铅蓄电池中消耗氢离子个数为4NA | |
| D. | lmol的Na2C03溶于盐酸形成混合溶液1L,常温下在pH=4时,c(CO32- )+c(H2C03)=0.lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的反应类型为加成反应 | |
| B. | X、Z均能与Na2CO3溶液反应 | |
| C. | X、Y、Z均能使溴水褪色,且原理相同 | |
| D. | X可作缩聚反应单体,Y可作加聚反应单体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:
A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,B的氢化物易溶于C的氢化物中,D的基态原子s轨道与p轨道上的电子数之比为2:3,且D为主族元素;E、F为副族元素,4s能级均只有一个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molMg在空气中完全燃烧生成MgO和Mg2N3,转移的电子数为NA | |
| B. | 14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA | |
| C. | 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol SO2 (g)的能量总和大于1 mo S(s)和1 mol O2(g)的能量总和 | |
| B. | 加入合适的催化剂,可增加单位质量的硫燃烧放出的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q1 kJ;Q1的值大于297.23 | |
| D. | 足量的硫粉与标况下1升氧气反应生成1升二氧化硫气体时放出297.23 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com