
| A、当电池负极消耗m g气体时,电解池阳极同时有m g气体生成 |
| B、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| C、电池的负极反应式为:O2+2H2O+4e-═4OH- |
| D、电池中c(KOH)不变 |
| m |
| 2 |
| m |
| 4 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
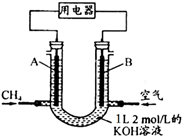 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素为Mn元素 |
| B、该元素原子核外有4个能层 |
| C、该元素原子最外层共有7个电子 |
| D、该元素属于d区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2加入水制备O2:2O22-+2H2O=4OH-+O2↑ |
| B、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com