
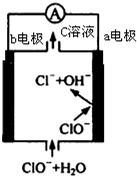
 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )| A. | 电池工作时,C溶液中的溶质是MgCl2 | |
| B. | 电池工作时,正极a附近的PH将不断增大 | |
| C. | 负极反应式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl- |
分析 该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-+2OH-=Mg(OH)2,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,据此分析.
解答 解:A.根据电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,所以C溶液中的溶质不含镁离子,故A错误;
B.放电时正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,所以a附近的PH将不断增大,故B正确;
C.根据电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,负极电极反应式为Mg-2e-+2OH-=Mg(OH)2,故C错误;
D.由可知b电极为正极发生还原反应,反应式为:ClO-+H2O+2e-=Cl-+2OH-,所以每转移0.1mol电子,理论上生成0.05mol Cl-,故D错误;
故选B.
点评 本题考查了原电池原理,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,题目难度不大.


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:解答题
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
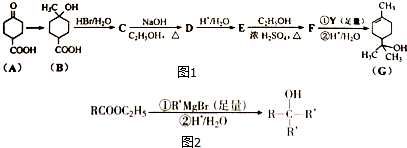
 ;
; .
.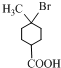 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:
前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃放烟花爆竹 | B. | 大力发展火力发电 | ||
| C. | 露天焚烧垃圾 | D. | 提高电动汽车的比例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )
元素周期表中钠元素的信息如图所示,对图中信息理解不正确的是( )| A. | 质子数为11 | B. | 元素名称为钠 | ||
| C. | 元素符号为 Na | D. | 核外电子数为22.99 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 下列有关说法正确的是( )
下列有关说法正确的是( )| A. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小 | |
| B. | 一定温度下,反应“2HI(g)=H2(g)+I2(g)△H>0”能自发进行,则该反应△S>0 | |
| C. | 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性 | |
| D. | 如图电池放电时的正极反应式:2Li++Li2O2+2e-=2Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下pH=5的盐酸溶液稀释103倍后,pH等于8 | |
| B. | 浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 | |
| C. | Na2CO3溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 常温下,pH=2的CH3COOH溶液与pH=12的KOH溶液等体积混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com