
【题目】【2017届湖南省长沙市长郡中学高三第一次模拟】
雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH=_________。
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是____
A.混合气体的密度不再变化 B.混合气体的平均分子量不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现______________(填“能”或“不能”)
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:___________________。
②洗涤含SO2的烟气。
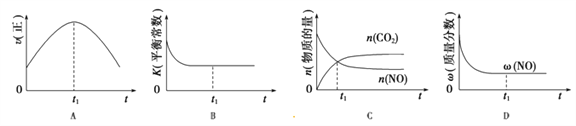
(4)汽车尾气净化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_________(填序号)。(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
② 写出NO与活性炭反应的化学方程式______________________;
②计算上述反应T1℃时的平衡常数K1=__________________;若T1<T2,则该反应的△H__________________0(填“>”、“<”或“=”)。
③ 上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________;
【答案】(1)4 (2)①D ②不能
(3)C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1
(4)BD,(5)①C(s)+2NO(g)=CO2(g)+N2(g) ②4,<③80%
【解析】
(1)根据表格提供的离子可知,NH4+ 水解导致试样溶液呈酸性,再根据电荷守恒可知,c(K+)+c(NH4+ )+c(Na+)+c(H+)=2c(SO42-)+c(Cl-)+c(NO3-),将表格中的数据代入得H+离子浓度为10-4,则PH值为4。
(2)①在恒容密闭容器中,混合气体的质量和体积始终不变,混合气体的密度也始终不变,密度不能作为达到平衡状态的判据,A项错误;该反应是气体体积不变的可逆反应,根据M=质量/n,则混合气体的平均分子量始终不变,不能作为达到平衡的判据,B项错误;N2、O2、NO的物质的量之比为1∶1∶2不能说明反应各物质的浓度保持不变,C项错误;氧气的百分含量不再变化,说明反应达到平衡状态,D项正确;答案选D。
②化学反应2CO(g)=2C(s)+O2(g)是一个熵减、吸热的反应,则△H-T△S>0,所以该设想不能实现。
(3)已知:①H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1、②C(s)+1/2O2(g) =CO(g) △H =-110.5kJ·mol-1,利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJmol-1)-(-241.81kJmol-1)=+13l.3 kJmol-1,所以焦炭与水蒸气反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H= +131.3 kJmol-1 。
(4)可逆反应达化学平衡状态时正逆反应速率不再变化,A项错误;该物质的浓度在化学平衡时保持不变,所以K不再变化,B项正确;对于恒容容器而言,各物质的物质的量不再改变,C项错误;平衡时NO的质量分数不再改变,D项正确,答案选BD。
(5)①由表中数据可知,C、NO、E、F的化学计量数之比为0.040:0.080:0.040:0.040 =1:2:1:1,反应中C被氧化,结合原子守恒可知,生成物为N2与CO2,且该反应为可逆反应,则反应方程式为C(s)+2NO(g) CO2(g)+N2(g)。
②从表中数据可知T1℃时的平衡浓度c(NO)=0.004mol/L,c(N2)=c(CO2)=0.008 mol/L,则T1℃时该反应的平衡常数为K1=(0.008×0.008)÷(0.004×0.004)=4;从T1到T2,NO的浓度增大,说明平衡逆向移动,若T1<T2,升高温度,平衡向吸热反应方向移动,则该反应的正向为放热反应,则△H < 0。
③在T1时,K=4,设NO的转化率为x,根据三段式解答:
C(s)+2NO(g) CO2(g)+N2(g)
起始浓度 0.04 0 0
变化浓度 0.04x 0.02x 0.02x
平衡浓度 0.04-0.04x 0.02x 0.02x
K=[0.02x×0.02x]÷[(0.04-0.04x)×(0.04-0.04x)=4,解得x=0.8,即达到新的平衡时,NO的转化率为80%。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.非极性分子中一定含有非极性键
D.元素的非金属性越强,其单质的活泼性一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中.反应后固体的质量—定增加的是
A. MnO2中加入H2O2溶液 B. 高温加热C与SiO2混合粉末
C. 加热Na2O2与NaHCO3的混合物 D. Cu丝插入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某100mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.4molL-1和0.1molL-1,向该混合液中加入1.92g铜粉,加热充分反应后,设溶液的体积仍为100 mL,则所得溶液的Cu2+的物质的量浓度为( )
A. 0.15molL-1 B. 0.225molL-1 C. 0.3molL-1 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的﹣1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题:
(1)B元素在元素周期表中的位置是第______周期______族;
(2)画出C元素的原子结构示意图______;
(3)与E的氢化物分子所含电子总数相等的分子是______(举一例,填化学式,下同)、阳离子是______;
(4)A与D形成的化合物中含有化学键的类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Co2O3在酸性溶液中易被还原成Co2+,且还原性:I->Fe2+>Cl->Co2+ 。下列反应在水溶液中不可能发生的是( )
A. Cl2+FeI2=FeCl2+I2
B. 3Cl2+6FeI2=2FeCl3+4FeI3
C. 2Fe3++2I-=2Fe2++I2
D. Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学知识用数轴表示能体现出形象直观、简明易记的特点,下列用数轴表示不合理的是
A. 平衡常数与转化率关系: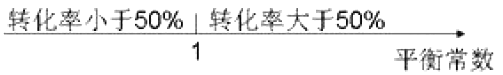
B. 向烧碱液中通入SO2后的产物: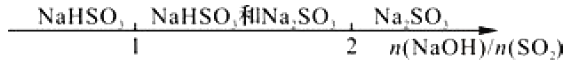
C. 铁和稀硝酸反应: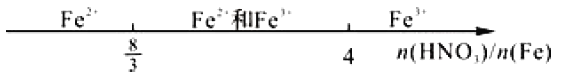
D. 向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: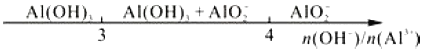
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com