
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
分析 (1)根据图象写出生成一氧化碳和二氧化碳的热化学方程式,再根据盖斯定律计算CO(g)生成CO2(g)与C(s)的热化学方程式;
(2)①由图表数据分析,反应在4min达到平衡,依据平衡常数概念计算,用生成物平衡浓度的幂次方乘积除以反应物的平衡浓度的幂次方乘积计算得到;
②依据反应的浓度商计算和该温度的平衡常数比较分析判断反应进行的方向;
(3)①在T2温度下,0~2s内,△c(CO2)=(0.3-0)mol/L=0.3mol/L,根据方程式知,△c(N2)=$\frac{1}{2}$△c(CO2),v(N2)=$\frac{△c}{△t}$;
要使$\frac{n(C{O}_{2})}{n(CO)}$ 增大,应使平衡向正反应方向移动,根据外界条件对化学平衡的影响判断;可以降温、加压或增大氢气的量或将H2O(g)从体系中分离;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
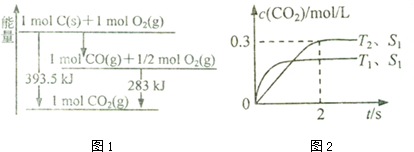
解答 解:(1)由图可知,1molC(s)与0.5molO2(g)反应得到1molCO(g)放出热量=393.5kJ-283kJ=110.5kJ,该反应热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol ①
1molC(s)与1molO2(g)反应得到1molCO2(g)放出热量393.5kJ,该反应热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②
根据盖斯定律,②-①×2得:2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol;
故答案为:2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol;
(2)①分析图表数据,4min达到平衡状态,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 0.4 0.6 0 0
变化量(mol/L) 0.2 0.2 0.2 0.2
平衡量(mol/L) 0.2 0.4 0.2 0.2
该温度下反应的平衡常数K=$\frac{0.2×0.2}{0.4×0.2}$=0.5,
故答案为:0.5;
②若向2L恒容密闭容器中充入lmolCO、4molH2O(g)、2molCO2、2molH2,浓度商Q=$\frac{1×1}{0.5×2}$=1>K=0.5,反应逆向进行,此时v(正 )<v(逆),
故答案为:<;
(2)①在T2温度下,0~2s内,△c(CO2)=(0.3-0)mol/L=0.3mol/L,根据方程式知,△c(N2)=$\frac{1}{2}$△c(CO2),v(N2)=$\frac{△c}{△t}$=$\frac{\frac{1}{2}×0.3mol/L}{2s}$=0.075mol/(L•s);
要使$\frac{n(C{O}_{2})}{n(CO)}$ 增大,应使平衡向正反应方向移动,因正反应放热,降低温度平衡向正反应方向移动;增大压强平衡向正反应方向移动;增大CO的物质的量或从体系中分离出N2;
故答案为:0.075mol/(L•s);降温或加压或增大CO的物质的量或将N2从体系中分离;
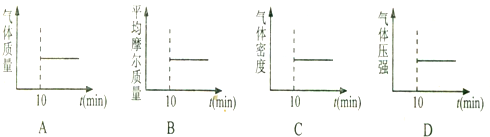
②A.根据质量守恒可知,在任何时候气体的质量不变,所以气体质量不变不能说明反应达到平衡,故A错误;
B.混合气体的摩尔质量等于气体的质量除以物质的量,根据质量守恒可知,在任何时候气体的质量不变,该反应是前后气体体积发生变化的反应,所以摩尔质量保持不变,说明反应达到平衡,故B正确;
C.混合气体密度等于质量除以体积,根据质量守恒可知,在任何时候气体的质量不变,而容器的体积也不变,所以混合气体的密度保持不变不能说明反应达到平衡,故C错误;
D.该反应是前后气体体积发生变化的反应,随着反应的正向进行,气体的压强减小,所以压强保持不变能说明反应达到平衡,故D正确;
故选BD.
点评 本题考查较为综合,涉及化学平衡的判断、化学平衡计算以及平衡移动等问题,难度不大,化学平衡状态的判断是高考的热点,注意化学平衡常数只与温度有关,与其他物理量无关.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42-、NO3- | B. | Na+、K+、Br -、AlO2- | ||
| C. | Na+、NO3-、Cl-、SO42- | D. | Na+、K+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下电离常数为Ka的酸HA溶液中c(H+)$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合:2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 483.6 kJ•mol-1 | B. | 241.8 kJ•mol-1 | C. | 571.6 kJ•mol-1 | D. | 285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com