
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
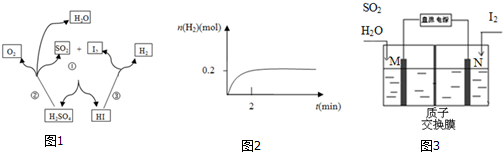
分析 (1)由图可知碘化氢分解生成单质碘和氢气;依据平衡常数概念计算K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$计算;
(2)反应①为二氧化硫与单质碘反应生成HI和硫酸;反应中S元素的化合价升高;
(3)二氧化硫和水、碘单质发生本生反应生成硫酸、氢碘酸,碘化氢分解生成碘和氢气;
(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3;
②根据化合价的代数和为零计算;
(5)电解时二氧化硫在阳极失电子生成硫酸;碘单质在N极得电子生成碘离子,与氢离子结合形成HI.
解答 解:(1)由图可知碘化氢分解生成单质碘和氢气,其反应的方程式为:2HI$\stackrel{△}{?}$H2+I2;
2HI $\stackrel{△}{?}$ H2 +I2
起始的浓度(mol/L):1 0 0
转化的浓度(mol/L):0.2 0.1 0.1
平衡的浓度(mol/L):0.8 0.1 0.1
则K=$\frac{c({H}_{2})×c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.1×0.1}{0.{8}^{2}}$=$\frac{1}{64}$;
故答案为:2HI$\stackrel{△}{?}$H2+I2;$\frac{1}{64}$;
(2)反应①为二氧化硫与单质碘反应生成HI和硫酸,其反应的方程式为:I2+SO2+2H2O=2HI+H2SO4;反应中S元素的化合价升高,则二氧化硫被氧化作还原剂,体现还原性;
故答案为:I2+SO2+2H2O=2HI+H2SO4;还原;
(3)二氧化硫和水、碘单质发生本生反应生成硫酸、氢碘酸,碘化氢分解生成碘和氢气,所以该反应释放的能源气体为氢气;
故答案为:H2;
(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3,其反应的方程式为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;
故答案为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;
②设CuFe2O3.86中Fe3+个数为x,Fe2+的个数为y,
由化合价的代数和为零得:2+3x+2y+(-2)×3.86=0,x+y=2,
则解得:$\frac{x}{y}$=43:7,所以CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 43:7;
故答案为:43:7;
(5)电解时二氧化硫在阳极失电子生成硫酸,其电极方程式为:SO2+2H2O-2e-=4H++SO42-;碘单质在N极得电子生成碘离子,M极附近产生的H+通过质子交换膜移动到N极附近,碘离子与氢离子结合形成HI;
故答案为:SO2+2H2O-2e-=4H++SO42-;M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
点评 本题考查了化学平衡常数的计算、氧化还原反应、化学方程式的书写、电解原理的应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握电解原理及电极方程式的书写方法.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 向某溶液中加入新制Cu(OH)2,加热出现红色沉淀 | 证明溶液中一定含醛类物质 |
| C | 取2mL 溴乙烷,加入适量NaOH水溶液,加热.一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 | 溴乙烷中的Br变成了Br- |
| D | 取2mL 溴乙烷,加入适量NaOH乙醇溶液,加热.将产生的气体通入Br2的四氯化碳溶液中,溶液褪色 | 反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com