
下列离子方程式中,正确的是( )
A. Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH﹣+O2↑
B. 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3﹣=3Fe2++2NO↑+4H2O
C. 氯化镁溶液与氨水反应:Mg2++2OH﹣=Mg(OH)2↓
D. 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+AlO2﹣+2H2O
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:选择题
将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是 ( )
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Cu、Cu2+、Fe D. Cu、Fe2+、Fe
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
对于化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);△H=a kJ/mol,下列叙述不正确的是( )
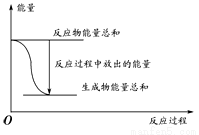
A. 反应过程中能量关系如上图表示,则该反应为放热反应
B. 若将该反应设计成原电池,锌为负极
C. 化学反应的焓变与反应方程式的计量数有关
D. 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:填空题
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2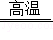 6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
6SO2+Fe3O4,该反应中氧化产物为________,若有3mol FeS2参加反应,转移电子的物质的量为_______.
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________.
(3)将一定量的Fe2O3溶于160mL 5mol•L﹣1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为______.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:选择题
以下说法正确的是( )
A. 往溶液中滴加盐酸产生使澄清石灰水变浑浊的气体,溶液中不一定存在CO32﹣
B. 滴加AgNO3溶液产生白色沉淀的溶液一定含Cl﹣
C. 往溶液中加入盐酸酸化的BaCl2溶液产生白色沉淀,则原溶液中含SO42﹣
D. 往溶液中滴加氯水和KSCN,溶液变红,则溶液中一定含Fe3+
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:实验题
A.[物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)Cu2+基态核外电子排布式为________,S、O、N三种元素的第一电离能由大到小为________。
(2)SO42-的立体构型是______,与SO42-互为等电子体的一种分子为_____(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________。
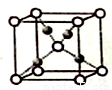
(4)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示,其中O2-的配位数是______________。
B.[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛 (实验装置见图,相关物质的沸点见附表)。其实验步骤为:
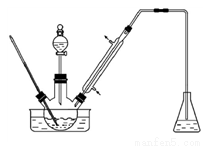
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_________。
(5)步骤4中采用减压蒸馏技术,是为了防止_____。
附表 相关物质的沸点(101kPa)
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
下列有关物质的浓度关系正确的是
A. 0.1mol•L-1HCl溶液与0.2mol•L-1氨水等体积混合(pH﹥7):c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)
B. Na2CO3溶液中:c(Na+)<c(CO32-)+c(HCO3-)
C. c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c((NH4)2SO4)
D. 0.1mol•L-1 (NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3mol•L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省凯里市高二下学期开学考试理综化学试卷(解析版) 题型:实验题
凯里一中2018届高一(1)班的两名同学用酸碱中和滴定的方法测定烧碱溶液的浓度。过程如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且30秒内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗盐酸为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察______________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)锥形瓶中的溶液从_______色变为_______色时,且30秒种不变化,停止滴定。
(3)该小组在步骤中①错误是______________,由此造成的测定结果分别是_______,(填偏高、偏低或无影响)。
(4)步骤②缺少的操作是______________________。
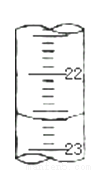
(5)如下图,是某次滴定时的滴定管中的液面,则其读数为_______mL。
(6)根据下列数据
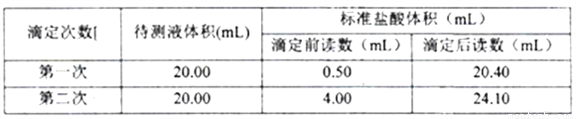
请计算待测烧碱溶液的浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省镇江市高二年级学业水平测试(必修)化学试卷(解析版) 题型:简答题
过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。

①装置A中发生反应的化学方程式为_______; 仪器X的名称为________。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为__________________。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴__________溶液。
步骤三:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体枳为V mL。产品中CaO2·8H2O的质量分数为_________ (用字母表示)[已知:I2+2S2O32-=2I-+ S4O62-]
(3)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能会生成CaO2。请限用下列试剂,设计实验检验钙在空气中燃烧所得固体中是否含有CaO2:______________(简要说明实验步骤、现象和结论)。限用试剂:稀盐酸、MnO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com