
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 左盘重,样品轻 | B. | 左盘轻,砝码重 | C. | 右盘重,砝码轻 | D. | 右盘轻重,样品重 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
常温下,浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | MOH的碱性强于ROH的碱性 | |
| B. | ROH的电离程度:b点大于a点 | |
| C. | 若两溶液无限稀释,则它们的c(OH-)相等 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于50mL | B. | 等于50mL | C. | 大于50mL | D. | 等于50/ρmL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol.L-l的NaAl02溶液和2.5 mol.L-l的盐酸等体积混合:2AlO${\;}_{2}^{-}$+5H+═Al(OH)3↓+Al3++H2O | |
| B. | 铜溶于0.5 mol.L-1的硝酸中:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| C. | 工业上将Cl2通人石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++Si${\;}_{4}^{2-}$═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
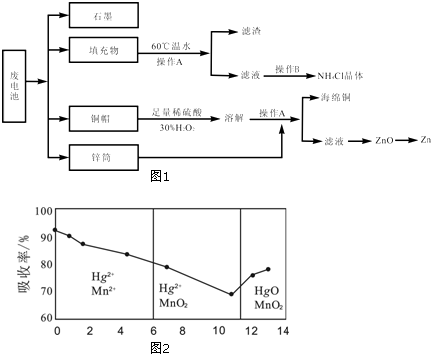
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com