
【题目】(1)同温同压下,同体积的甲烷(CH4)和二氧化碳原子总数之比为_____,密度之比为_____。
(2)在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,则其中CO2为____ mol。
(3)9.03×1023个NH3含___mol氢原子,在标准状况下的体积为____L。
【答案】5:3 4:11 0.75 4.5 33.6
【解析】
(1)同温同压下,气体的体积之比等于物质的量之比,因此同体积的甲烷和二氧化碳物质的量之比为1:1,分子数目之比为1:1,1个CH4分子中含有5个原子,1个二氧化碳分子中含有3个原子,分子数目相同,则原子数目之比为5:3,密度之比等于摩尔质量之比,即为16:44=4:11;
(2)在标准状况下,CO和CO2的混合气体共39.2L,则两种气体的物质的量之和为![]() ,设CO2物质的量为x mol,则CO物质的量为(1.75-x)mol,混合气体的质量为61g,可列式:
,设CO2物质的量为x mol,则CO物质的量为(1.75-x)mol,混合气体的质量为61g,可列式:![]() ,解得x=0.75mol,即CO2物质的量为0.75mol;
,解得x=0.75mol,即CO2物质的量为0.75mol;
(3)1mo任何物质中含有6.02×1023个分,则9.03×1023个氨(NH3)分子含氨分子的物质的量为![]() =1.5mol,1个氨分子中含有3个氢原子,则9.03×1023个氨(NH3)分子含1.5mol×3=4.5mol氢原子;标准状况下,氨气所占的体积为1.5mol×22.4L/mol=33.6L。
=1.5mol,1个氨分子中含有3个氢原子,则9.03×1023个氨(NH3)分子含1.5mol×3=4.5mol氢原子;标准状况下,氨气所占的体积为1.5mol×22.4L/mol=33.6L。


科目:高中化学 来源: 题型:
【题目】在电镀车间的含铬酸性废水中,铬的存在形式有Cr(Ⅵ)和Cr(Ⅲ)两种,其中以Cr(Ⅵ)的毒性最大。电解法处理含铬废水如图,铬最终以Cr(OH)3沉淀除去。下列说法正确的是
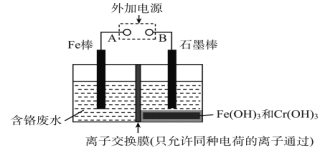
A. Fe为阳极,反应为Fe-2e-=Fe2+
B. 阴极反应为Cr2O72-+7H2O+6e-=2Cr(OH)3↓+8OH-
C. 阳极每转移3mol电子,可处理Cr(Ⅵ)物质的量为1mol
D. 离子交换膜为质子交换膜,只允许H+穿过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 mol·L1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.用250mL容量瓶等仪器配制成250mL烧碱溶液;
B.用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂;
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为M molL﹣1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数V1 mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点耗酸体积V2 mL。
回答下列问题:
(1)正确的操作步骤是(填写字母)________→________→________→D→________;
(2)滴定时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________________;
(3)终点时颜色变化是_____________________;
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_____(填字母序号);
A.滴定终点读数时俯视 B.锥形瓶水洗后未干燥
C.酸式滴定管使用前,水洗后未用盐酸润洗 D.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)该烧碱样品的纯度计算式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为

A. 7∶2
B. 5∶4
C. 3∶5
D. 2∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是一座开放的“元素大厦”,”元素大厦”尚未客满。若发现120号元素,请在“元素大厦”中安排好它的“房间”
A.第七周期0族B.第七周期第IIA族C.第八周期第IIA族D.第八周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径的大小W <X<Y B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态 D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向1.0 L密闭容器中加入0.60 mol X(g),发生反应X(g)![]() Y(s)+2Z(g) ΔH>0,测得反应物X的浓度与反应时间的数据如下表:
Y(s)+2Z(g) ΔH>0,测得反应物X的浓度与反应时间的数据如下表:

(1)0~3 min用Z表示的平均反应速率v(Z)=____。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是_____________。由此规律推出反应在6 min时反应物的浓度a为____mol·L-1。
(3)反应的逆反应速率随时间变化的关系如图所示,t2时改变的条件可是______、_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com