
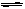 2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。
2EC3(气)在两个密闭容器中进行, A容器中有一个可上下移动的活塞, B 容器可保持恒容 (如图所示) ,若在 A 、B 中分别充入lmolC2和2molEC2,使V (A ) =" V" ( B ) ,在相同温度下反应,则:① 达平衡所需时间:t(A ) t ( B )(填>、<、二,或:无法确定,下同)。平衡时 EC2的转化率:a( A ) _a( B )。 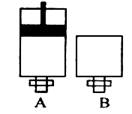
 2SO3是体积减小的可逆反应,在反应过程中压强是减小的。这说明在反应过程中A中的压强大于B中的压强,压强大反应速率快,到达平衡的时间少,所以达平衡所需时间:t(A ) < t ( B );压强大有利于平衡向正反应方向移动,所以反应物的转化率高,即平衡时 EC2的转化率:a( A ) >a( B )。
2SO3是体积减小的可逆反应,在反应过程中压强是减小的。这说明在反应过程中A中的压强大于B中的压强,压强大反应速率快,到达平衡的时间少,所以达平衡所需时间:t(A ) < t ( B );压强大有利于平衡向正反应方向移动,所以反应物的转化率高,即平衡时 EC2的转化率:a( A ) >a( B )。

科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X最高价氧化物对应的水化物不一定是强酸 |
| B.X元素的氢化物化学式一定为H2X |
| C.X的单质—定是良好的半导体材料 |
| D.X元素的氧化物—定能与烧碱反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钡的溶解度略大于硫酸钡,向硫酸钡的饱和溶液中加入较多的碳酸钠固体,会有碳酸钡生成 |
B.某温度T时,水的离子积常数为KW,该温度下将V1mLa mol?L-1的一元酸HA与V2mLb mol?L-1的一元碱BOH充分混合,若混合溶液中c(OH-)= mol?L-1,则此溶液不一定呈中性 mol?L-1,则此溶液不一定呈中性 |
| C.ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 |
D.依据反应2C+SiO2 2CO↑+Si ,还原性:Si <C 2CO↑+Si ,还原性:Si <C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | W | |
| X | Y | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com