

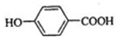
 ��
�� ���÷�Ӧ����Ϊȡ����Ӧ��
���÷�Ӧ����Ϊȡ����Ӧ�� ��д�ṹ��ʽ����
��д�ṹ��ʽ�������� ��A�ķ���ʽΪC7H8�����պϳɶ��ǻ������ᶡ����֪��AΪ�ױ� ���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ
���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ �������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ
�������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ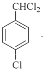 ��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ����D�������Ϣ�ٿ�֪��DΪ
��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ����D�������Ϣ�ٿ�֪��DΪ ��D�ڴ���������ȩ������������E��EΪ
��D�ڴ���������ȩ������������E��EΪ ��E�ڼ��Ը��¸�ѹ�����£������Ϣ�ۿ�֪�������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ
��E�ڼ��Ը��¸�ѹ�����£������Ϣ�ۿ�֪�������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ ��F�ữ���ɶ��ǻ�������G��
��F�ữ���ɶ��ǻ�������G�� �����ݴ˽��
�����ݴ˽��
��� �⣺��1���Ʊ����ǻ������ᶡ����AΪ�ױ� ���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ
���ױ����������������£���������λ�ϵ�Hԭ������������ȡ����Ӧ����B��BΪ �������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ
�������Ϣ�ڿ�֪��D�к���ȩ����B�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����C��CΪ ��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ����D��DΪ
��C����������ˮ��Һ�У����ϵ���ԭ�ӷ���ȡ����Ӧ����D��DΪ ��D�ڴ���������ȩ������������E��EΪ
��D�ڴ���������ȩ������������E��EΪ ��E�ڼ��Ը��¸�ѹ�����£������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ
��E�ڼ��Ը��¸�ѹ�����£������ϵ�Clԭ�ӱ�ȡ������F��ͬʱ����������Ӧ��FΪ ������ʽΪ��C7H4O3Na2��
������ʽΪ��C7H4O3Na2��
�ʴ�Ϊ��C7H4O3Na2��
��2��FΪ ��F�ữ���ɶ��ǻ�������G��
��F�ữ���ɶ��ǻ�������G�� ����
����
�ʴ�Ϊ�� ��
��
��3����B����C�� �ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ����
�ڹ��������£����ϵ�Hԭ������������ȡ����Ӧ���� ����Ӧ�Ļ�ѧ��Ӧ����ʽΪΪ��
����Ӧ�Ļ�ѧ��Ӧ����ʽΪΪ�� ��
��
�ʴ�Ϊ�� ��ȡ����Ӧ��
��ȡ����Ӧ��
��4��EΪ ��E��ͬ���칹���к��б������ܷ���������Ӧ������ȩ�������к˴Ź������������ֲ�ͬ��ѧ�������⣬�������Ϊ2��2��1����
��E��ͬ���칹���к��б������ܷ���������Ӧ������ȩ�������к˴Ź������������ֲ�ͬ��ѧ�������⣬�������Ϊ2��2��1����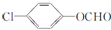 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5�������ǻ����������������л������е�̼̼˫���������������ǻ�ʱ�ȱ���̼̼˫������CH2=CHCH2ClΪԭ�Ϻϳ�CH2=CHCOOH����CH2=CHCH2Cl�ڼ���������ˮ��õ�CH2=CHCH2OH��CH2=CHCH2OH���Ȼ��ⷢ���ӳ�����CH3CHClCH2OH������������ȩ��ȩ������������CH3CHClCOOH�������������ƵĴ���Һ�з�����ԭ�ӵ���ȥ��Ӧ������CH2=CHCOOH���ϳ�·������ͼΪ��CH2=CHCH2Cl$\stackrel{����������ˮ��}{��}$
CH2=CHCH2OH$\stackrel{HCl}{��}$CH3CHClCH2OH$\stackrel{Cu/Ag}{��}$CH3CHClCHO$��_{��}^{����}$CH3CHClCOOH$��_{��}^{�������ƵĴ���Һ}$CH2=CHCOOH��
�ʴ�Ϊ��CH2=CHCH2Cl$\stackrel{����������ˮ��}{��}$
CH2=CHCH2OH$\stackrel{HCl}{��}$CH3CHClCH2OH$\stackrel{Cu/Ag}{��}$CH3CHClCHO$��_{��}^{����}$CH3CHClCOOH$��_{��}^{�������ƵĴ���Һ}$CH2=CHCOOH��
���� ���⿼���л���ϳɺ��ƶϣ����л���ѧ�е���Ҫ���ͣ��л��ϳɹ�����Ҫ���������ŵ����롢�����ŵ������������ŵ��ܱ䡢̼�Ǽܵı仯�ȣ�ע����ݷ���ʽ��϶��ǻ������ᶡ��ȷ��A�Ľṹ�������ķ�Ӧ����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼ | B�� | �� | C�� | �� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�������c ��OH-��=10-13mol•L-1����Һ�У�Na+��Ba2+��Cl-��Br- | |
| B�� | c��H+��/c��OH-��=1012����Һ�У�Fe2+��Al3+��NO3-��Cl- | |
| C�� | ������Al3+����Һ�У�K+��Na+��SO42-��ClO- | |
| D�� | ��ɫ��Һ�У�K+��Na+��MnO4-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ԫ���ǻ�ԭ�� | B�� | O2�������� | C�� | H2����������Ӧ | D�� | O2����ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 14g��N2��13C2H2��ɵĻ���������ĵ�����Ϊ7NA | |
| B�� | ��״���£�11.2L NO��11.2L O2��Ϻ������ķ�����С��0.75NA | |
| C�� | �����£�1L PH=3��Al2��SO4��3��Һ�У�ˮ�������H+��ĿΪ10-3NA | |
| D�� | ��100mL 1 mol•L-5 Na2S02��Һ��1.12 L����״����CL2�ķ�Ӧ�У�•��ԭ��ʧ����0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 | Fe��OH��3 |
| Ksp | 4.96��10-9 | 6.82��10-6 | 4.68��10-6 | 5.61��10-12 | 2.64��10-39 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
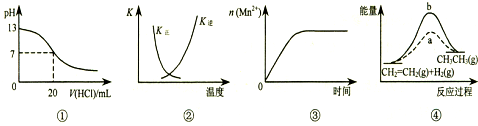
| A�� | ͼ�ٱ�ʾ25��ʱ����0.1 mol•L-1����ζ�20 mL 0.1 mol•L-1 NaOH��Һ����Һ��pH�����������ı仯 | |
| B�� | ͼ�������߱�ʾ��Ӧ2SO2��g��+O2��g��?2SO3��g������H��0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 | |
| C�� | ͼ�۱�ʾ10 mL 0.01 mol•L-1 KMnO4 ������Һ�������0.1 mol•L-1 H2C2O4��Һ���ʱ��n��Mn2+�� ��ʱ��ı仯 | |
| D�� | ͼ����a��b���߷ֱ��ʾ��ӦCH2=CH2 ��g��+H2��g����CH3CH3��g������H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com