
【题目】金属铬与铁具有相似的化学性质。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
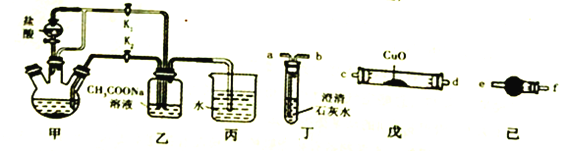
I.组装实验仪器后,首先进行必要的操作A。
II.往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液,再往其它仪器中加入相应的药品。
III.关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
IV.待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液自动转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗旋塞。
V.将装置乙中混合物快速过滤、洗涤和干燥,称量。
回答下列问题:
(1)步骤I中“操作A”为_____________;装置丙中导管口水封的目的主要是_________________________________。
(2)三颈烧瓶中的锌除与盐酸反应外,另发生的一个反应的化学方程式为_______________。
(3)步骤IV中溶液自动转移至装置乙中的实验操作为_______________;生成红棕色晶体的离子反应方程式____________________________。
(4)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(5)一定条件下[Cr(CH3COO)2]2·2H2O受热反应得到的气态产物含CO、CO2。请从丁、戊、己装置中选取必要装置检验这两种气体(不考虑尾气处理):
气态产物→_______________________→a(填接口字母序号)。
(6已知实验所用到的试剂中,CrCl3溶液中含溶质19.02g,0.1mol/L醋酸钠溶液为1.6L,其它反应物足量。实验后得到纯净干燥的[Cr(CH3COO)2]2·2H2O晶体11.28g,则该实验所得产品的产率为________(结果保留2位有效数字)。
【答案】 检查装置气密性 避免空气(或氧气)进入装置乙 Zn+2CrCl3═ZnCl2+2CrCl2 打开K2关闭K1 2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O↓ ②① abfecd(或abfedc) 75%
【解析】试题分析:(1)该实验涉及氢气的制备,组装实验仪器后,首先进行的操作是检查装置气密性;醋酸亚铬水合物易被氧化;(2)金属铬与铁具有相似的化学性质,根据Zn与FeCl3反应分析;(3)根据压强原理分析溶液自动转移至装置乙中的方法;甲中的CrCl2与乙中CH3COONa反应生成[Cr(CH3COO)2]22H2O;(4)根据醋酸亚铬水合物易溶于盐酸,微溶于乙醇,难溶于水和乙醚分析;(5)检验CO、CO2,先用石灰水检验CO2,再除去并干燥CO2,用热的氧化铜检验CO,最后用石灰水检验氧化产物CO2;(6)根据2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O↓ 计算产品的产率;
解析:(1)该实验涉及氢气的制备,组装实验仪器后,首先进行必要的操作是检查装置气密性;醋酸亚铬水合物易被氧化,装置丙中导管口水封的目的是避免空气(或氧气)进入装置乙;(2)Zn与FeCl3反应生成氯化亚铁和氯化锌,金属铬与铁具有相似的化学性质,所以Zn与CrCl3能反应,方程式是Zn+2CrCl3═ZnCl2+2CrCl2;(3)根据压强原理,打开K2关闭K1,甲中溶液能自动转移至装置乙中;甲中的CrCl2与乙中CH3COONa反应生成[Cr(CH3COO)2]22H2O,反应离子方程式是2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O↓;(4)洗涤[Cr(CH3COO)2)]2·2H2O产品,因为醋酸亚铬水合物,微溶于醇,易溶于盐酸,所以不能用能乙醇和盐酸;先用水洗去表面的离子,再用乙醚来洗去多余的水,所以洗涤时使用的先后顺序②①;(5)检验CO、CO2,先用石灰水检验CO2,再除去并干燥CO2,用热的氧化铜检验CO,最后用石灰水检验氧化产物CO2;仪器的连接顺序是→ a→ b→f→e→c→d→a;(6) 19.02g CrCl3的物质的量是0.12mol,0.1mol/L醋酸钠溶液为1.6L,含醋酸钠0.16mol,根据2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O↓,醋酸钠不足,根据醋酸钠的物质的量,生成[Cr(CH3COO)2]22H2O 0.04mol,质量是0.04mol![]() 376g/mol=15.04g,该实验所得产品的产率为11.28g
376g/mol=15.04g,该实验所得产品的产率为11.28g![]() 。
。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)可用作有机合成的氯化剂和催化剂。
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) > Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
POCl3 | 2.0 | 105.3 | 153.5 |
实验室制取POCl3并测定产品纯度的实验过程如下:
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:
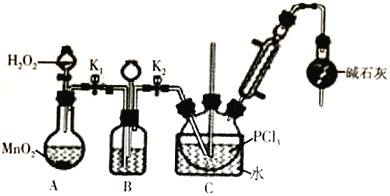
(1)装置C中盛装PCl3的仪器名称为_______________________;氧气氧化PCl3的化学方程式为_______________________________。
(2)仪器组装完成后,检查装置B气密性的方法是_______________________________。
(3)装置B的作用有________________________________(回答两点)。
(4)装置C的反应温度控制在60-65℃之间,原因是____________________________________。
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为___________溶液。
(6)步骤③的目的是___________________________________________________。
(7)测得产品中POCl3的纯度为__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl样品中含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
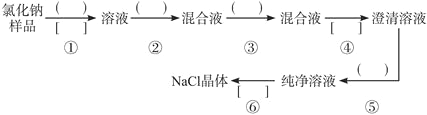
(1)流程第②③步中应分别使用________、_________试剂,第⑥步中应进行_________操作
(2)写出第⑤步发生反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
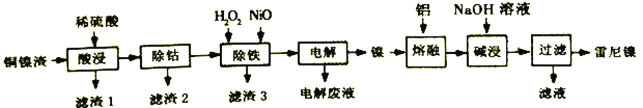
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】工业合成有机物F的路线如下:
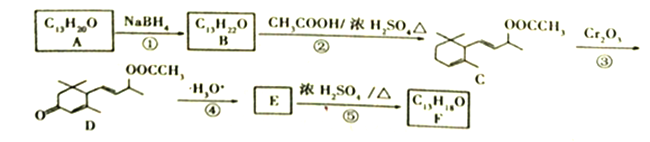
已知:①![]() ;
;
②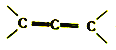 结构不稳定,不子考虑。
结构不稳定,不子考虑。
(1)A中含氧官能团的名称为_______________;C→D反应③的类型为_____________。
(2)化合物B的结构简式为__________;F与Br2按物质的量之比1:1加成所得产物有____种。
(3)E→F的化学方程式为___________________________。
(4)上述转化关系中,设计步骤②和④的目的是______________________________________。
(5)H是A的同分异构体,任写一种满足以下条件的H的结构简式________________。
①与FeCl3溶液发生显色反应。
②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12。
(6)参照上述合成路线,设计并写出用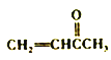 合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:

下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象所得出的结论中,正确的是( )
A. 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32-
B. 某物质焰色反应呈黄色,结论:该物质是钠盐
C. 无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3
D. 无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的有机化工原料,可用于制取氢气、甲酸甲酯(HCOOCH3)。(1) 在一定条件下用氧气催化氧化甲醇制氢气,原料气中n(O2)/n(CH3OH)对反应的选择性影响如图所示(选择性越大表示生成的该物质越多)。当n(O2)/n(CH3OH)=0.25 时,主要反应的化学方程式为____________,制备H2 时最好控制n(O2)/n(CH3OH)=___________。

(2)甲醇催化脱氢制甲酸甲酯的反应为:2CH3OH(g)![]() HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
HCOOCH3(g)+2H2(g) △H =a kJ·mol-1
①已知 :CO(g)+ l/2O2(g)=CO2(g) △H1 =-283kJ·mol-1
2CH3OH(g)+O2(g)=2CO2(g)+4 H2(g) △H2 =-386kJ·mol-1
2CO(g)+2 H2(g)=HCOOCH3(g ) △H3 =-134kJ·mol-1
a=_________________。
②在310℃下,将2mol 甲醇置于VL恒容密闭容器中,反应20 分钟后到达平衡,平衡时甲醇和氢气的分压相等。从开始到平衡时甲醇的平均反应速率为____ mol·L-1·min-1,若平衡时气体总压为P总=5×104Pa,Kp=_______。(已知: Kp是用平衡气体分压代替平衡浓度求得的平衡常数。气体分压=气体总压×气体的物质的量分数)。若在310℃下,将2mol 甲醇置于VL恒压密闭容器中,反应到达平衡时甲醇的分压______氢气的分压(填“>”,“=”或“<”)。
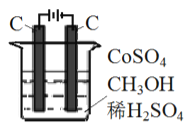
(3) 电解法可消除甲醇对水质造成的污染,原理是: 通电将Co2+ 氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,请写出:
①阴极的电极反应式_______________________________________。
②除去甲醇的离子方程式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com