
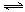 2SO3(g) ����H<0����Ӧ������A���ֺ��¡����ݣ�B���ֺ��¡���ѹ�������ﵽƽ��״̬������˵���У���ȷ����
2SO3(g) ����H<0����Ӧ������A���ֺ��¡����ݣ�B���ֺ��¡���ѹ�������ﵽƽ��״̬������˵���У���ȷ���� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ʵ���� | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol��L��1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol��L��1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol��L��1��s��1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 n Z (g) +2 W (g)��2 min ĩ������0.2 mol W ������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05 mol��(L��min)-1�����㣺
n Z (g) +2 W (g)��2 min ĩ������0.2 mol W ������֪��Z��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.05 mol��(L��min)-1�����㣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
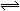 2SO��(g) ������Ӧ���ȣ����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��
2SO��(g) ������Ӧ���ȣ����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��| A�������л��������ܶȱ��ֲ��� | B��ÿ���ģ�molO2��ͬʱ���ɣ�molSO3 |
| C�������������ѹǿ���� | D��SO3������������SO2������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��vA=1mol��L��1��min��1 | B��vB=1mol��L��1��min��1 |
| C��vC=2mol��L��1��min��1 | D��vB=2mol��L��1��min��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.3 | B��0.3 mol/��L��s�� |
| C��0.4 mol��L��s��-1 | D��0.04 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Na2SO4(s) | B��CuSO4��Һ | C��H2SO4��Һ | D��H2O? |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com