
【题目】下列实验方案、现象、得出的结论均正确的是( )
选项 | 实验及现象 | 结论 |
A | 用酸度计测定 |
|
B | 向待测液中依次滴入氯水和 | 待测溶液中含有 |
C | 向酸化的 | 证明 |
D | 其他条件相同,测定等浓度的 | td style="width:153.75pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.62pt; vertical-align:middle">
A.AB.BC.CD.D
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2(反应主要装置如图一所示,其它装置省略)。当盐酸达到一个临界浓度时,反应就会停止。为测定反应残余液中盐酸的临界浓度,探究小组同学提出了下列实验方案:
甲方案:将产生的Cl2与足量AgNO3溶液反应,称量生成的AgCl质量,再进行计算得到余酸的量。
乙方案:采用酸碱中和滴定法测定余酸浓度。
丙方案:余酸与已知量CaCO3(过量)反应后,称量剩余的CaCO3质量。
丁方案:余酸与足量Zn反应,测量生成的H2体积。
具体操作:装配好仪器并检查装置气密性,接下来的操作依次是:
①往烧瓶中加入足量MnO2粉末
②往烧瓶中加入20mL 12molL-1浓盐酸
③加热使之充分反应。
(1)在实验室中,该发生装置除了可以用于制备Cl2,还可以制备下列哪些气体______?
A. O2 B. H2 C. CH2=CH2 D. HCl
若使用甲方案,产生的 Cl2必须先通过盛有 ________(填试剂名称)的洗气瓶, 再通入足量 AgNO3溶液中,这样做的目的是 ______________;已知AgClO易溶于水,写出Cl2与AgNO3溶液反应的化学方程式________________
(2)进行乙方案实验:准确量取残余清液,稀释5倍后作为试样。准确量取试样25.00mL,用1.500mol·L-1NaOH标准溶液滴定,选用合适的指示剂,消耗NaOH标准溶液23.00mL,则由此计算得到盐酸的临界浓度为 ____ mol·L-1(保留两位有效数字);选用的合适指示剂是 _____。
A 石蕊 B 酚酞 C 甲基橙
(3)判断丙方案的实验结果,测得余酸的临界浓度_________ (填偏大、偏小或―影响)。(已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11)
(4)进行丁方案实验:装置如图二所示(夹持器具已略去)。
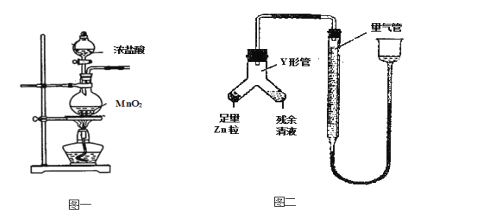
(i)使Y形管中的残余清液与锌粒反应的正确操作是倾斜Y形管,将 _____转移到_____中。
(ii)反应完毕,需要读出量气管中气体的体积,首先要___________,然后再______,最后视线与量气管刻度相平。
(5)综合评价:事实上,反应过程中盐酸浓度减小到临界浓度是由两个方面所致,一是反应消耗盐酸,二是盐酸挥发,以上四种实验方案中,盐酸挥发会对哪种方案带来实验误差(假设每一步实验操作均准确)?____________
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡(Sn)、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
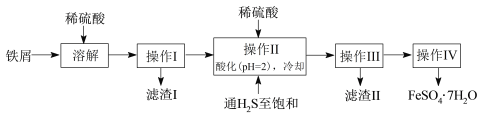
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)溶解时需加热,当看到_____________________________________(填现象)时应停止加热,并趁热进行操作I的原因是______________________________________。
(2)操作II中,通入硫化氢至饱和的目的是_______________________________;在溶液中用硫酸酸化至pH= 2的目的是_________________________________。
(3)操作IV的顺序依次为:____________、____________、______________。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_____________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是_________________________________。
②计算上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
A.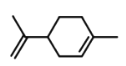 和
和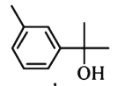 都属于芳香族化合物
都属于芳香族化合物
B. 和
和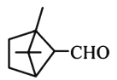 分子中所有碳原子均处于同一平面上
分子中所有碳原子均处于同一平面上
C. 、
、 和
和 均能使酸性
均能使酸性![]() 溶液褪色
溶液褪色
D. 和
和 均能与新制的
均能与新制的![]() 反应生成红色沉淀
反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法不正确的是
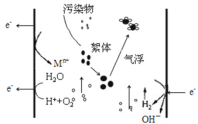
A.每产生1molO2,整个电解池中理论上转移电子数为4NA
B.阴极电极反应式为2H2O + 2e- = H2↑+2OH—
C.若铁为阳极,则阳极电极方程式为Fe-2e-=Fe2+和2H2O - 4e- = O2↑+4H+
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有七种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: I1=738kJ·mol-1 I2=1451kJ·mol-1 I3=7733kJ·mol-1 I4=10540kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:___。
(2)B元素基态原子中能量最高的电子的电子云在空间有___个伸展方向,原子轨道呈___形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为![]() ,该同学所画的电子排布图违背了___。
,该同学所画的电子排布图违背了___。
(4)E位于第__族、__区,该元素原子的核外电子排布式为___。
(5)检验D元素的方法是___,请用原子结构的知识解释产生此现象的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为______
(2)B元素的![]() 价离子和C元素的
价离子和C元素的![]() 价离子的核外电子排布情况均与氩原子相同,则B元素的
价离子的核外电子排布情况均与氩原子相同,则B元素的![]() 价离子的结构示意图为______,C元素原子有______个能层,______个能级,______个非空原子轨道
价离子的结构示意图为______,C元素原子有______个能层,______个能级,______个非空原子轨道
(3)D元素的![]() 价离子的3d能级为半充满状态,D的元素符号为______,其基态原子的核外电子排布式为______
价离子的3d能级为半充满状态,D的元素符号为______,其基态原子的核外电子排布式为______
(4)E元素基态原子的M层全充满,N层只有一个电子,E的元素符号为______,其基态原子的简化电子排布式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期第ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
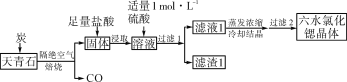
已知:①经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质
②SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10
③SrCl2·6H2O的摩尔质量为267 g·mol-1
(1)工业上天青石焙烧前先研磨粉碎,其目的是___
(2)工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有硫元素被还原,转移了3 mol电子。写出该反应的化学方程式____
(3)加入硫酸的目的是_____;为了提高原料的利用率,滤液1中Sr2+的浓度应不高于__________mol·L-1(注:此时滤液1中Ba2+浓度为1×10-5 mol·L-1 )。
(4)滤渣1的主要成分是____________,滤液1经蒸发浓缩、冷却结晶、过滤后,需对所得的六水氯化锶晶体进行洗涤、干燥。证明六水氯化锶晶体已洗涤干净的实验操作及现象为___________
(5)工业上常通过电解熔融SrCl2制锶单质。由SrCl2·6H2O制取氯化锶的方法是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com