
| A�� | ����о������������ϡ����������ˮ�����õ�ľ��C5H10O5�����ڶ��ǻ�ȩ��ľ����Ũ����������ÿ����ɿ�ȩ ����ľ�����ɿ�ȩ�ķ�Ӧ����ȥ��Ӧ ����ľ�����ɿ�ȩ�ķ�Ӧ����ȥ��Ӧ | |
| B�� | ȩ�ࡢ�����ǡ����ἰ�����������ܷ���������Ӧ | |
| C�� | ��˹������Ŀǰʹ����㷺����ζ������ṹ��ʽΪ ���������ᷴӦ������Ӧ����һ�ֳ����İ����� ���������ᷴӦ������Ӧ����һ�ֳ����İ����� | |
| D�� | BAD��һ�����������ռ������Ľṹ��ʽ���£� 1 mol BAD����ܺͺ�6 mol NaOH����Һ���з�Ӧ 1 mol BAD����ܺͺ�6 mol NaOH����Һ���з�Ӧ |
���� A����ȥˮ���ɿ�ȩ��
B��ȩ�ࡢ�����ǡ����ἰ��������������ȩ����
C������������
D�������������Ʒ�Ӧ�Ĺ�����Ϊ���ǻ���������
��� �⣺A��C5H10O5��ȥˮ����̼̼˫����Ϊ��ȥ��Ӧ����A��ȷ��
B��ȩ�ࡢ�����ǡ����ἰ��������������ȩ�������ɷ���������Ӧ����B��ȷ��
C�����а������Ȼ����ļ��������������ڰ����ᣬ��C����
D�������������Ʒ�Ӧ�Ĺ�����Ϊ���ǻ�����������������ˮ�����ɷ��ǻ����Ȼ�����1 mol BAD����ܺͺ�6 mol NaOH����Һ���з�Ӧ����D��ȷ��
��ѡC��
���� ���⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ���㣬���չ����������ʵĹ�ϵΪ���Ĺؼ���ע������л���Ľṹ�����ŵ����ʣ���Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
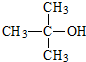
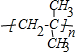
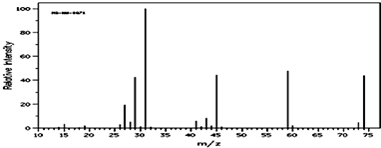
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2������Ư��ֽ�� | B�� | ��ʯ�ҿ����ڸ������� | ||
| C�� | ����������ʴ�̲��� | D�� | ̼�����ƿ������к�θ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �¶� | C�� | Ũ�� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
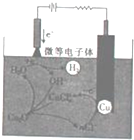 ������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺
������ͭ��Cu2O����Ϊһ����Ҫ��������ԭ�ϣ���Ϳ�ϡ���ɫ�����ʹ������������Ź㷺����;���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
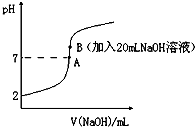 ����ᣨHF����һԪ���ᣬ��ˮ��Һ�еĵ��뷽��ʽΪ��HF�TH++F-��25���£���20mL0.2mol•L-1��������еμ�0.2mol•L-1��NaOH��Һʱ����Һ��pH�仯��ͼ��ʾ��
����ᣨHF����һԪ���ᣬ��ˮ��Һ�еĵ��뷽��ʽΪ��HF�TH++F-��25���£���20mL0.2mol•L-1��������еμ�0.2mol•L-1��NaOH��Һʱ����Һ��pH�仯��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HN3ˮ��Һ����Ũ�ȴ�С˳��Ϊ��c��H+����c�� N3-����c��HN3����c��OH-�� | |
| B�� | NaN3ˮ��Һ������Ũ�ȴ�С˳��Ϊ��c��Na+����c�� N3-����c��OH-����c��H+�� | |
| C�� | HN3��NH3�������ɵĵ��������ǿ����� | |
| D�� | N3-��CO2��Ϊ�ȵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com