
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
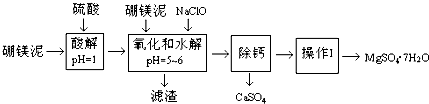
分析 硼镁泥主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体,以此来解答.
解答 解:硼镁泥主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体,
(1)需用1mol/L的硫酸800mL,若用98%的浓硫酸(ρ=1.84g/mL)来配制,结合溶液配制前后溶质的物质的量不变可知,量取浓硫酸为$\frac{1mol/L×1L}{\frac{1000×1.84×98%}{98}}$=0.054L=54mL,则选择量筒为100mL,故答案为:D;
(2)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(3)SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液PH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤得滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,故答案为:MnO2、SiO2;
(4)检验滤液中Fe3+是否被除尽,检验方法为取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+;
(5)由温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤,便得到MgSO4•7H2O晶体,
故答案为:蒸发浓缩(结晶);趁热过滤;
(6)硼镁泥主要成份是MgO(占40%),则100g中含Mg为100g×40%×$\frac{24}{40}$×100%=24g,由Mg原子守恒可知得到MgSO4•7H2O为$\frac{24g}{24g/mol}$×246g/mol=246g,则MgSO4•7H2O的产率为$\frac{172.2g}{246g}$×100%=70%,故答案为:70%.
点评 本题考查混合物分离提纯,为高频考点,涉及混合物的分离提纯、离子的检验、氧化还原反应、产率计算等知识,把握实验流程及物质的性质为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是氯酸钙 | |
| B. | 将过量铁粉加入稀硝酸中,有气体生成,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| C. | 将铜粉加1.0mol•L-1Fe2(SO4)3溶液中,溶液变蓝、有黑色固体出现 | |
| D. | 二氧化硅是制造光导纤维的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同 | |
| B. | 白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | |
| C. | CsCl晶体中每个Cs+周围紧邻的Cl-和每个Cl-周围紧邻的Cs+个数相等 | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W<X<Y<Z | |
| B. | W与X、Y、Z分别形成最简单化合物中最稳定的是Z | |
| C. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬(Cr)有许多种化合物,在工业生产中有广泛的用途.
铬(Cr)有许多种化合物,在工业生产中有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
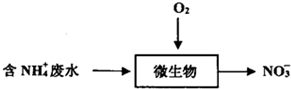
| A. | 生物硝化法处理废水,会导致水体pH逐渐下降:NH4++202=NO3-+2H++H20 | |
| B. | 长期过量使用NH4Cl等铵态化肥,易导致土壤酸化,水体富营养化 | |
| C. | 检验NH4+所需的试剂是浓NaOH溶液,湿润的蓝色石蕊试纸 | |
| D. | 微生物保持活性的pH范围为7〜9,可以加入石灰石来调节水体的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:S2->Na+ | B. | 热稳定性:HCl>HF | ||
| C. | 酸性:H3BO3>H2CO3 | D. | 碱性:Al(OH)3>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .1mol乙最多可与5mol H2反应.
.1mol乙最多可与5mol H2反应. RCHO+R′CHO
RCHO+R′CHO .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热金属铝使之熔化 | B. | 液态SO3受热蒸发 | ||
| C. | 加热HI气体使之分解 | D. | 加热石英晶体使之熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com