
【题目】Weiss利用光敏剂QD制备2—环已基苯乙烯(c)的过程如图。下列说法不正确的是( )
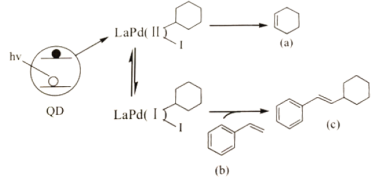
A.a的二氯代物有3种
B.1molb完全燃烧消耗10molO2
C.c具有顺式和反式2种结构
D.a、b、c均能使溴水和稀高锰酸钾溶液褪色
科目:高中化学 来源: 题型:
【题目】下列判断中,正确的是( )
A.泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
B.将CH3COONa溶液从20℃升温至30℃,溶液中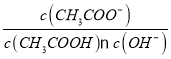 增大
增大
C.某物质的溶液中由水电离出的c(H+)= 1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
D.已知25℃时NH4CN显碱性,则25℃时的电离常数K(NH3·H2O)>K(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.在10lkPa、120℃时,1gH2完全燃烧生成气态水,放出120.9kJ的热量,则1mol氢气在10lkPa、25℃时燃烧放出的热量应小于241.8kJ
C.已知:2SO2(g)+O2(g)![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
D.由石墨比金刚石稳定可知:C(金刚石,s)= C(石墨,s);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种固定烟气中CO2的工艺流程如下:
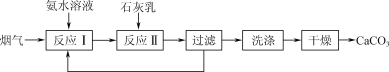
(1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________。
(2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。
a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度
(3) 若测得滤液中c(CO32-)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。
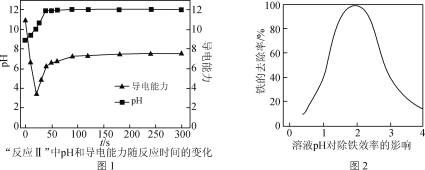
(5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。
①除铁时应控制溶液的pH为________(填字母)。
a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5
② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研机构设计如图装置,利用K2Cr2O7实现含苯酚废水的有效处理,一段时间后,中间室中NaCl溶液的浓度减小。下列说法正确的是( )
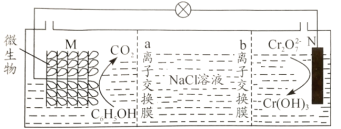
A.M为该电池的正极
B.该装置在高温下处理含苯酚废水效果更佳
C.a为阳离子交换膜,b为阴离子交换膜
D.N电极反应式为:Cr2O![]() +6e-+8H+=2Cr(OH)3↓+H2O
+6e-+8H+=2Cr(OH)3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)中,表示该反应速率最快的是:
3C(g)+4D(g)中,表示该反应速率最快的是:
A.V(A)=0.5mol·L-1·s-1B.V(B)=0.3mol·L-1·s-1
C.V(C)=0.8mol·L-1·s-1D.V(D)=1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素位于元素周期表中_____区,基态Cu原子有______种不同能级的电子。
(2)铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如下反应实现铜离子的富集回收。
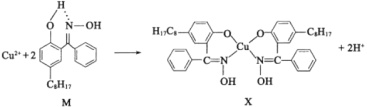
①M所含元素的电负性由大到小的顺序为______(用元素符号表示)。
②X中采用sp3杂化的非金属原子有______(填元素名称)。
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是_______,Y的沸点比水低的主要原因是_______。
(4)向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。通过上述实验现象可知,与Cu2+的配位能力:H2O________NH3(填“大于”或“小于”)。
(5)CuCl2和CuCl是铜的两种氯化物。
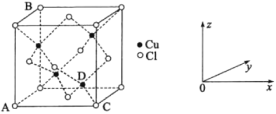
①图中表示的是_______(填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为______。
③晶胞中C、D两原子核间距为298 pm,阿伏加德罗常数的值为NA,则该晶体密度为__g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com