
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是:
A 反应①的正反应是吸热反应
B 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C 达平衡(I)时,X的转化率为5/11
D 在平衡(I)和平衡(II)中,M的体积分数相等
【答案】C
【解析】
试题分析:降温后达平衡(Ⅱ),隔板左边体系体积减小,说明反应①中平衡向正反应方向移动,故正反应为放热反应,A错误;已知反应②反应前后气体的物质的量不变。恒温达平衡(Ⅰ)时, 隔板左右两边体系压强相同, 由阿伏加德罗定律得n(①)/n(②)=V(①)/V(②), 反应①达平衡(Ⅰ)时气体的物质的量为: n(①)=2×2.8/2.2 mol=28/11 mol, 达平衡(Ⅰ)时体系气体的总物质的量为: 28/11 mol+2 mol=50/11 mol, 由阿伏加德罗定律知平衡(Ⅰ)与反应开始时体系的压强之比为50/11∶5=10∶11, B错误;由题意得:
X(g) + 2Y(g)![]() 2Z(g)
2Z(g)
反应前 1 mol 2 mol 0
变化量 α mol 2α mol 2α mol
平衡(Ⅰ)(1-α)mol (2-2α)mol 2α mol
1-α+2-2α+2α=28/11,解得α=5/11,C正确;平衡(Ⅰ)与平衡(Ⅱ)温度不同,平衡状态一定不同,M的体积分数不相等,D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】氨是最重要的化工产品之一,其生产方法也在逐渐改进中,各国科学家均在为提高氨的产量,降低能耗做各种有益的探究; 氨在工业上有广泛用途。
(1)合成氨用的 H2 可以 CH4 为原料制得。已知相关的化学键键能数据如下:
则 CH4(g)与 H2O(g)反应生成 CO(g)和 H2(g)的热化学方程式 。
(2)近年有人将电磁场直接加在氮气与氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了 较好的产率。从化学反应本质角度分析,电磁场对合成氨反应的作用是 。
(3)在 425℃、A12O3 作催化剂,甲醇与氨气反应可以制得(CH3)2NH。(CH3)2NH 显弱碱性,与盐酸反应 生成(CH3)2NH2Cl ,溶液中各离子浓度由小到大的顺序为 。
(4)直接供氨式碱性燃料电池的电池反应式 4NH3 + 3O2 = 2N2+ 6H2O,负极电极反应式为 。
(5)如下图,采用 NH3 作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含 量,从而确定烟气脱氮率,反应原理为:NO(g) +NO2(g)+2NH3(g)![]() 2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)
2N2(g) + 3H2O(g)。(注:脱氮率即氮氧化物转化率)

①对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也 可以表示平衡常数(记作 KP),则上述反应的 KP=_______。
②以下说法正确的是________。
A.上述反应的正反应为吸热反应。
B.相同条件下,改变压强对脱氮率没有影响。
C.催化剂①、②分别适合于 250℃和 450℃左右脱氮
D.曲线①、②最高点表示此时平衡转化率最高
(6)氨气制取尿素[CO(NH2)2]的合成塔中发生反应:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________(填序号)范围内
CO(NH2)2(l)+H2O(g)。下图 为合成塔中不同氨碳比 a [n(NH3)/n(CO2)] 和水碳比 b [n(H2O)/n(CO2)]时二氧化碳转化率(x%)。b 宜控制在__________(填序号)范围内
A.0.6~0.7 B.1~1.1 C.1.5~1.6
a 宜控制在 4.0 左右,理由是___________。
(7)氨氧化法制硝酸工业中,可用尿素溶液除去尾气中氮氧化物(NO 和 NO2)。尾气中的 NO、NO2 与 水反应生成亚硝酸,亚硝酸再与尿素反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化 物(假设 NO、NO2 体积比为 1:1)的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
⑴ Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是_______。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
⑵ Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式 ;该反应为_______(填“吸”或者“放”)热反应,原因是 _____________。
⑶ CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。
⑷ 在200℃并用钴做催化剂的条件下,CO与H2可合成C5H12(汽油的一种成分),可减少碳排放。反应中能量变化如下图所示,写出该反应的热化学方程式______________。

⑸ 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用、构建低碳环保社会。请说明该转化的优点_____________________。
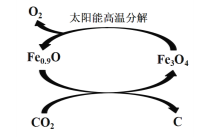
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:150 ℃时, NO2发生分解反应2NO2(g)![]() 2NO(g)+O2(g) ΔH>0。向容积为1 L的密闭容器中通入0.05 mol NO2,在150 ℃时充分反应,达到平衡后测得c(NO)=0.04 mol/L。
2NO(g)+O2(g) ΔH>0。向容积为1 L的密闭容器中通入0.05 mol NO2,在150 ℃时充分反应,达到平衡后测得c(NO)=0.04 mol/L。
(1)能说明上述反应已经达到平衡状态的是________(填字母)。
A.容器内气体的颜色不再变化
B.容器内压强不再变化
C.容器内气体的密度不再变化
D.容器内气体的平均摩尔质量不再变化
E.v逆(NO2)=v正(NO)
F.相同时间内,每消耗2个NO2分子,即可生成2个NO分子
(2)150 ℃时上述反应的平衡常数K=________(填数值)。
(3)下列有关该反应的图像中正确的是__________(填字母)。

(4)发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知: N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ/mol。[来源则N2H4(g)和NO2反应的热化学方程式为___________________________。
(5)若向500 mL 0.1 mol/L的CH3COONa溶液中加入250mL 0.1 mol/L的HNO3,此时溶液显酸性,则所得混合溶液中离子浓度的大小顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]某研究小组以烃A为主要原料,采用以下路线合成药物X和高聚物Y:

已知:![]()
![]()
 (R或R'可以是烃基或H原子)。
(R或R'可以是烃基或H原子)。
请回答下列问题:
(1)X的分子式为_____________,X中的含氧官能团有____________。
(2)E的结构简式为____________________,反应③的条件是_____________________,反应⑤的反应类型是________________
(3)写出反应④的化学方程式:__________________________。
(4)写出同时符合下列条件的E的一种同分异构体的结构简式:________________
①属于酚类化合物,且是苯的对位二元取代物;②能发生银镜反应和水解反应。
(5)以CH3CHO为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
合成路线的书写格式参照如下示例流程图:CH3CH2OH![]()
![]()
![]() BrH2C—CH2Br
BrH2C—CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
①用50 mL量筒量取5.2 mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量17.7 g氯化钠晶体;
④向小试管中加入100ml稀盐酸。
A. ①② B. ②③ C. ③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法正确的是
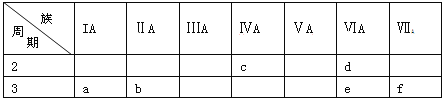
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是( )
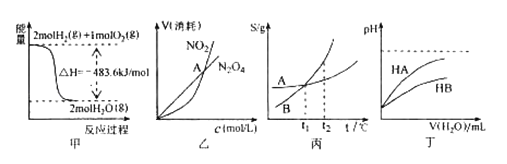
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJmol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味的物质,该物质是
A.甲烷 B.甲醛 C.氨气 D.二氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com