
| A. | 在100℃、101 kPa条件下,液态水的汽化热为40.69 kJ•mol-1,则H2O(g)?H2O(l)△H=40.69 kJ•mol-1 | |||||||||||
| B. | 已知:
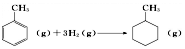 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| C. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||||
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
分析 A.从不同状态的物质之间的转化判断,一般来说,气体转化为液体、液体转化为固体,反之吸热;
B.苯环中不存在典型的碳碳双键和碳碳单键,不能用表中数据进行计算;
C.依据正反应和逆反应的活化能分析判断;
D.△H与反应的条件无关.
解答 解:A.气体转化为液体是放热过程,则正确的表达为:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故A错误;
B.因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故B错误;
C.正逆反应的活化能之差即为该反应的焓变数值,在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1,故C正确;
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故D错误;
故选C.
点评 本题考查了热化学方程式书写、反应热的计算,对焓变的理解即正逆反应的活化能之差,以及△H与反应的条件无关,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 油脂是热值最高的营养物质,可以制造肥皂和油漆 | |
| B. | 利用二氧化碳制造全降解塑料,符合绿色化学理念 | |
| C. | 脱脂棉、滤纸、蚕丝的主要成分均为纤维素,完全水解能得到葡萄糖 | |
| D. | 酒精、福尔马林用于杀菌消毒的原理都是使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品中加入着色剂 | B. | 轮船船身装锌块防腐 | ||
| C. | 在糕点包装内放置抗氧化剂 | D. | 燃煤发电时用煤粉代替煤块 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
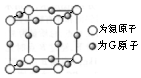 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
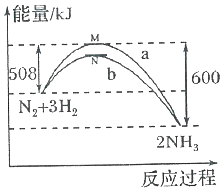 在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )
在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )| A. | 状态M和N均表示2molN(g)+6mol H(g) | |
| B. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-l | |
| C. | 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量 | |
| D. | 使用催化剂,并不能改变反应的△H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com