
【题目】下列元素的单质,工业上一般不使用电解法制取的是( )
A.钠B.铝C.铁D.氯
科目:高中化学 来源: 题型:
【题目】在2020年抗击新冠肺炎的战役中,化学物质发挥了重要作用。下列说法正确的是( )
A.医用消毒酒精中乙醇的体积分数为95%
B.生产医用防护口罩的原料聚丙烯纤维属于纯净物
C.抗病毒疫苗冷藏存放的目的之一是避免蛋白质变性
D.84消毒液可作为环境消毒剂,其有效成分为次氯酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: _____________________________________________________________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________;计算该反应的平衡常数K=____________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________(填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________(填“升高”或“降低”),a________0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
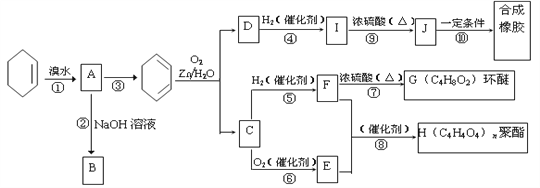
已知:R1-CH=CH-R2 ![]() R1-CHO+R2-CHO
R1-CHO+R2-CHO
(1)F的名称是___________,C中含有的官能团的名称是______________。
(2)③的反应条件是_________________________。
(3)写出下列反应类型:⑥_________________,⑨______________。
(4)写出②反应化学方程式: ____________________________。
(5)写出⑩反应化学方程式:________________________________________。
(6)试写出C与新制银氨溶液反应的化学方程式:_________________________
(7)D的一种同分异构体,可发生加成聚合反应,且能和NaHCO3反应,有三种氢原子,核磁共振氢谱面积比为1:2:3,试写出结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“中国制造”所用材料属于有机高分子材料的是
A.北京大兴国际机场航站楼所用水泥
B.北斗卫星太阳能电池板所用高纯硅
C.国产航母“山东舰”舰身所用无磁镍铬钛合金钢
D.医用口罩中间过滤层所用高熔融指数聚丙烯(PP)材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com