
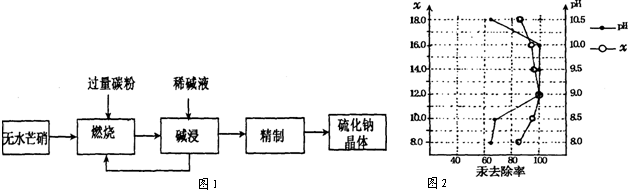
分析 根据图1可知,制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡抑制硫离子水解,通过精制获得硫化钠晶体,
(1)煅烧中得到等物质的量的CO和CO2,S元素被还原得到Na2S;
(2)热水促进硫化钠水解,用碱液抑制硫化钠水解;
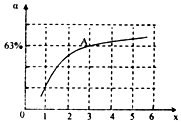
(3)硫化钠实际用量与理论用量比值x越小、汞除去率越高,最佳效果;
(4)根据Cu(OH)2溶度积可求得c(Cu2+),代入CuS的溶度积求得c(S2-);
(5)Cu由+2价变为+1价,得电子,在阴极生成,反应式为:2Cu2++2e-+H2O=Cu2O↓+2H+.
解答 解:(1)煅烧中得到等物质的量的CO和CO2,S元素被还原得到Na2S,反应方程式为3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
故答案为:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解;
故答案为:热水能促进Na2S水解,而稀碱可抑制Na2S水解;
(3)硫化钠实际用量与理论用量比值x越小、汞除去率越高,最佳效果,由图象可知当pH介于9~10时,x=12时汞的除去率最大;
故答案为:pH介于9~10之间,x=12;
(4)溶液pH=4,则溶液中c(OH-)=10-10 mol/L,根据Cu(OH)2溶度积可得c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2 mol/L,代入CuS的溶度积可得c(S2-)=$\frac{8.8×1{0}^{-36}}{2.2}$mol/L=4.0×10-36 mol/L;
故答案为:4.0×10-36 mol/L;
(5)电解生成Cu2O,Cu元素由+2价变为+1价,得电子,发生还原反应,则Cu2O在阴极生成,发生电极反应式为:2Cu2++2e-+H2O=Cu2O↓+2H+,由于反应中有H+生成,所以溶液的pH降低;
故答案为:阴极;降低;2Cu2++2e-+H2O=Cu2O↓+2H+.
点评 本题是对化学与技术的考查,涉及常见化学工业、对操作的分析评价、对条件的控制、溶度积计算、电解原理等,侧重考查学生理论联系实际的能力、阅读获取信息的能力、知识迁移应用,难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸型酸雨的形成涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH?CH3COO-+H+ | |
| D. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的气体A与气体B,所含分子数目之比为a:b | |
| B. | 气体A与气体B的摩尔质量之比为a:b | |
| C. | 相同条件下,a g气体A与b g气体B体积之比为b:a | |
| D. | 相同条件下,气体A与气体B的密度之比为b:a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时.切取绿豆大小的金属钠,用滤纸吸干表面煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置;下层液体显紫红色;则氧化性:Fe3+>I2 | |
| C. | 测定等浓度的Na2CO3和Na2SO3 溶液的pH;前者pH 比后者的大;则非金属性:S>C | |
| D. | 溴乙烷与 NaOH 溶液共热后,加入AgNO3溶液;未出现淡黄色沉淀;说明溴乙烷没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题: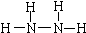 .
.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 标准状况下,22.4L 甲醇中含有的氧原子数为1NA | |
| C. | 1mol羟基中电子数为10NA | |
| D. | 在30 g甲醛和醋酸的混合物中,含有碳原子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
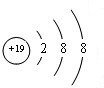
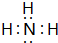 ;⑨的最高价氧化物对应的水化物
;⑨的最高价氧化物对应的水化物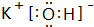 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com