
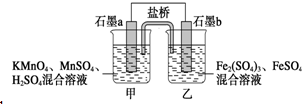
 某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )
某小组将反应2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计为如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为2mol•L-1,溶液的体积均为200mL,盐桥中装有饱和K2SO4溶液.下列说法中错误的是( )| A. | 电池工作时,盐桥中的SO42-移向乙烧杯 | |
| B. | 石墨b的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 当有0.1 mol SO42-进入烧杯时,反应消耗H+0.2 mol | |
| D. | 当 MnSO4浓度变为2.2 mol•L-1时,反应中转移电子0.2 mol(不考虑溶液的体积变化) |
分析 由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
解答 解:A、原电池中阴离子影响负极,b为负极,所以盐桥中的SO42-移向乙烧杯,故A正确;
B、Fe元素的化合价升高,失去电子,电极反应式为Fe2+-e-═Fe3+,故B正确;
C、当有0.1 mol SO42-进入烧杯时,转移0.2mol电子,据2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,每转移10mol电子有16mol氢离子消耗,所以转移0.2mol电子,消耗氢离子为3.2mol,故C错误;
D、每生成1molMnSO4转移电子5mol,MnSO4浓度变为2.2 mol•L-1时,生成MnSO40.04mol,转移电子0.2mol,故D正确;
故选C.
点评 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,答题时注意体会电极方程式的书写方法,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1 的H2SO4溶液中所含H+的个数为0.1NA | |
| B. | 100mL 0.1mol•L-1的NH4Cl溶液所含NH4+的个数为0.01NA | |
| C. | 电解精炼铜的过程中,外电路转移NA个电子,阴极生成铜的质量为32g | |
| D. | 将2molSO2和10molO2充入一密闭容器中完全反应后,生成SO3的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳与浓硫酸加热 | B. | 浓硫酸与NaCl固体加热 | ||
| C. | 浓硫酸中加入铜片 | D. | 蔗糖与浓硫酸混合后炭化发黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吃馒头时多咀嚼后有甜味 | |
| B. | 淀粉溶液和稀H2SO4共热一段时间后,滴加碘水不显蓝色 | |
| C. | 把生鸡蛋煮成熟鸡蛋 | |
| D. | 油脂与NaOH溶液共煮后可以制得肥皂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com