
分析 A可发生银镜反应,说明还原醛基,能够与钠反应生成氢气,说明含有羟基,相对分子质量为150且无支链,A为OHCCHOHCHOHCHOHCH2OH,A与乙酸发生酯化反应,生成B,B为酯,B被氧化生成C,C含有羧基,C与乙醇发生酯化反应生成D,据D的相对分子质量可知D为CH3CH2OOCCH(OOCCH3)CH(OOCCH3)CH(OOCCH3)CH2OOCCH3,据此分析.
解答 解:A可发生银镜反应,说明还原醛基,能够与钠反应生成氢气,说明含有羟基,相对分子质量为150且无支链,A为OHCCHOHCHOHCHOHCH2OH,A与乙酸发生酯化反应,生成B,B为酯,B被氧化生成C,C含有羧基,C与乙醇发生酯化反应生成D,据D的相对分子质量可知D为CH3CH2OOCCH(OOCCH3)CH(OOCCH3)CH(OOCCH3)CH2OOCCH3,
(1)D为CH3CH2OOCCH(OOCCH3)CH(OOCCH3)CH(OOCCH3)CH2OOCCH3,分子式为C15H22O10,故答案为:C15H22O10;
(2)A为OHCCHOHCHOHCHOHCH2OH,发生银镜反应的化学方程式为OHCCHOHCHOHCHOHCH2OH+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOCCHOHCHOHCHOHCH2OH+2Ag↓+3NH3+H2O,
故答案为:OHCCHOHCHOHCHOHCH2OH+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOCCHOHCHOHCHOHCH2OH+2Ag↓+3NH3+H2O.
点评 本题考查了有机物推断和化学方程式书写,注意根据有机物相对分子质量和官能团推断有机物分子式的方法,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 该混盐水溶液呈碱性 | |
| B. | 该混盐与H2SO4反应有气体生成 | |
| C. | 该混盐溶液加入BaCl2可以生成白色沉淀 | |
| D. | 该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
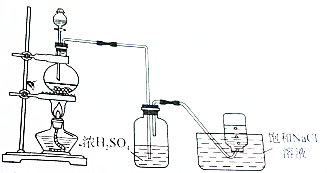
| A. | 浓H2SO4和NaCl晶体 | B. | 甲酸和浓H2SO4(制CO) | ||
| C. | MnO2和浓硫酸 | D. | 浓H3PO4和NaBr晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | Na2CO3 | C. | Na2CO3、NaHCO3 | D. | NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
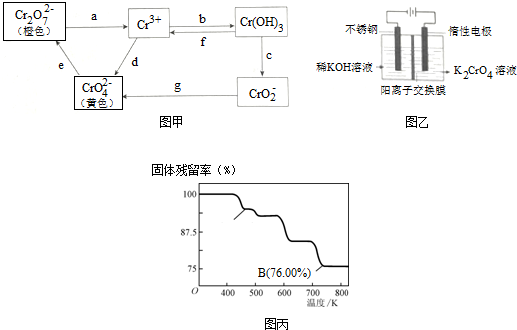
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
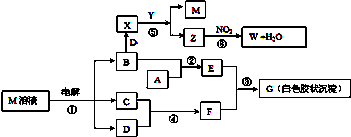
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液清洗油污,加热可增强其去污能力 | |
| B. | 门窗玻璃、陶瓷餐具、玛瑙手镯、砖瓦所用材料为硅酸盐材料 | |
| C. | 聚丙烯酸钠是一种高吸水性树脂 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com