
【题目】测定CuSO4·xH2O 晶体的x值,数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )
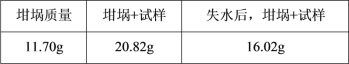
A.晶体中含不挥发杂质B.未做恒重操作
C.加热前晶体未研磨D.加热时有晶体溅出
【答案】D
【解析】
根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水,都会造成测量结果偏高、偏低,结合x的理论值为5.0,进行分析解答。
由表格中的数据,硫酸铜晶体的质量为:20.82g11.70g=9.12g,结晶水的质量为:20.82g16.02g=4.8g,
则CuSO4xH2O![]() CuSO4+xH2O,
CuSO4+xH2O,
160+18x 18x
9.12g 4.8g
解得x=9.88>5,测定结果偏大,
A. 硫酸铜晶体中含不挥发杂质,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故A错误;
B. 未做恒重操作,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,故B错误;
C. 加热前晶体未研磨,测定的结晶水质量偏小,则测定结果偏小,故C错误;
D. 加热过程中有少量晶体溅出,导致水的质量测定结果偏大,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为(CO,CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
ii:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
iii:CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应2中相关化学键键能数据如下:
化学键 | H—H | C=O | C≡O | H—O |
E/KJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=___kJ·mol-1。已知ΔH1=-63kJ·mol-1,则ΔH3=___kJ·mol-1。
(2)对于反应1,不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,请回答下列问题:
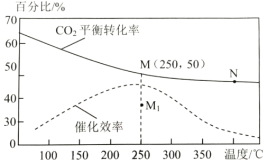
①下列说法不正确的是(__________)
A.M点时平衡常数比N点时平衡常数大
B.温度低于250℃时,随温度升高甲醇的平衡产率降低
C.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
②若在刚性容器中充入3molH2和1molCO2发生反应1,起始压强为4MPa,则图中M点CH3OH的体积分数为___,250℃时反应的平衡常数Kp=___(MPa)-2(保留三位有效数字);
③若要进一步提高甲醇产率,可采取的措施有___(写两条即可)
(3)相同条件下,一定比例CO/CO2/H2混合气体甲醇生成速率大于CO2/H2混合气体甲醇生成速率,结合反应1、2分析原因:___。
(4)以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
CH3COOH(g),在不同温度下催化剂的催化效率与乙酸的生成速率如图所示:
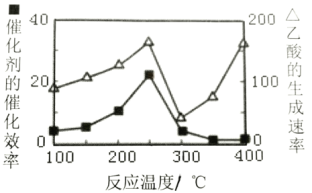
250~300℃时,乙酸的生成速率降低的主要原因是___。
300~400℃时,乙酸的生成速率升高的主要原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。

(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中不正确的是( )

A.白屈菜酸的同分异构体中可能含有芳香族化合物
B.所有碳原子可以共面
C.1mol白屈菜酸完全燃烧需要O2的物质的量为4mol
D.能通过加聚反应形成高分子物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见下图,下列说法正确的是( )
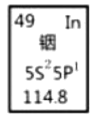
A.铟元素的质量数是114.8
B.铟元素的相对原子质量是115,中子数为66
C.铟元素是一种主族元素,位于第五周期第ⅢA族
D.铟原子最外层有5个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究铁与氯气的反应途径及产物。
(问题提出)
(1)资料1:液氯能在钢瓶中储存。
资料2:铁与氯气在加热条件下能发生反应
资料3:铁与氯水能反应。实验:将铁粉放入氯水中,铁粉溶解,无气泡产生。
①经检验氯水呈酸性,原因是________(用化学方程式表示)。
②依据实验现象,判断氯水中与Fe反应的微粒可能为_________。
据此,小组认为Fe与Cl2的反应与温度、湿度有关,探究如下。
(实验探究) 资料:高于300℃时FeCl3升华
(2)湿润的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅰ |
| 常温时将铁丝伸入A中,铁丝迅速变黑 |
Ⅱ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
①实验Ⅰ,向A中加水,经检验产物中有FeCl2,推测其形成的可能途径:
途径一: Fe + Cl2 = FeCl2
途径二: 2Fe + 3Cl2 = 2FeCl3,_________。
②实验Ⅱ,_________(填操作和现象),A中产物含+3价铁。
(3)干燥的Cl2与Fe的反应:
实验 | 装置 | 操作及现象 |
Ⅲ |
| 常温时将铁丝伸入A中, 铁丝慢慢变 黑,大量气体剩余。 |
Ⅳ | 将红热的铁丝伸入A中,铁丝剧烈燃烧,产生大量棕黄色烟。 |
实验Ⅲ中有大量Cl2剩余,实验Ⅳ几乎无Cl2剩余,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橡胶分解后的产物是碳氢化合物,它含碳88.2%、氢11.8%,此烃的蒸气密度是同温同压下氢气密度的34倍,求它的分子式,此物质0.5mol能与160g溴单质起加成反应,在生成物中溴原子是分布在不同的碳原子上的,进一步研究时,又知溴代物结构上有一个碳原子是在支链上,根据这些条件,写出该碳氢化合物的分子式、结构简式并用系统命名法命名。______、______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
![]()
(1)A的氢化物分子式为___________。
(2)B的元素符号为_________,原子结构示意图为______,在周期表中位于第_______周期_______族;
(3)C的单质分子式为___________,C的单质溶于水所得溶液叫____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平衡体系mA(g)+nB(g)![]() pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
A.②④B.②③C.①④⑤D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com