
| A、V:3d34s2 |
| B、Cr:3d44s2 |
| C、Ar:3s23p6 |
| D、Ni:3d84s2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验编号 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | PH=9 |
| 乙 | c1 | 0.2 | PH=7 |
| A、甲反应后的溶液中:c(HA)+c(A-)=0.05mo1?L-1 |
| B、c1一定大于0.2 mo1?L-1 |
| C、0.1 mo1?L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L |
| D、乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.- 4 |
- 4 |
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
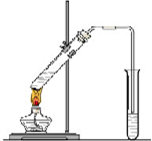 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素X和Y可能是同周期元素 |
| B、元素X不可能是ⅡA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素Y在化学性质上与锡相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 操作 | 实验现象及结论 | 结沦是 否可靠 | 判断依据 |
| 甲 | 取少量黄色溶液,加入四氯化碳,振荡、静置. | 下层溶液呈橙红色,证明Br2不能将Fe2+氧化为Fe3+. | ① | ② (填文字) |
| 乙 | 取少量黄色溶液,加入 几滴淀粉碘化钾溶液. | 溶液变为蓝色,证明Br2能 将Fe2+氧化为Fe3+. | ③ | ④ (写离子方程式) |
| 丙 | 取少量黄色溶液,加入 几滴 ⑤ | 溶液变为红色,证明Br2能 将Fe2+氧化为Fe3+. | 可靠 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com