
分析 (1)根据n=$\frac{m}{M}$计算碳酸钠物质的量,根据n=cV计算溶液中Na+物质的量,再计算NaCl物质的量,根据m=nM计算加入NaCl的质量;
(2)根据碳原子守恒计算二氧化碳物质的量,根据2Na2O2+2CO2=2Na2CO3+O2计算生成氧气物质的量,再根据V=nVm计算氧气体积.
解答 解:(1)10.6g 碳酸钠物质的量为$\frac{10.6g}{106g/mol}$=0.1mol,Na+物质的量为1L×0.4mol/L=0.4mol,则加入NaCl物质的量为0.4mol-0.1mol×2=0.2mol,加入NaCl的质量为0.2mol×58.5g/mol=11.7g,
答:需要加入NaCl的质量为11.7g;
(2)根据碳原子守恒n(CO2)=n(Na2CO3)=0.1mol,根据2Na2O2+2CO2=2Na2CO3+O2,可知生成氧气物质的量为0.1mol×$\frac{1}{2}$=0.05mol,故标况下生成氧气体积为0.05mol×22.4L/mol=1.12L,
答:标况下生成氧气体积为1.12L.
点评 本题考查化学方程式计算、物质的量浓度有关计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO${\;}_{3}^{2-}$) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3OONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
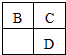
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 | |
| D. | A、B、C三种元素形成的化合物,晶体类型一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
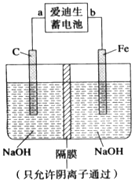 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 最外层有5个电子的原子不一定是非金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
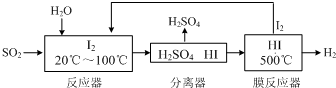
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 425mL | B. | 560mL | C. | 250mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
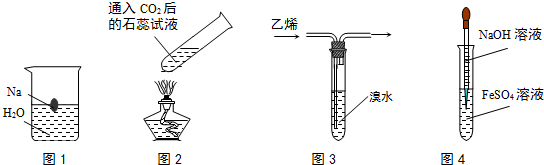
| A. | 图1中溶液颜色变化:无色→红色 | |
| B. | 图2中溶液颜色变化:红色→紫色 | |
| C. | 图3中溴水颜色变化:红棕色→无色 | |
| D. | 图4中生成的沉淀颜色变化:白色→绿色→红褐色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com