
| A. | 1.5 g甲基所含有的电子数目为0.9NA | |
| B. | 在1L0.1 mol•L-1Na2S溶液中,阴离子总数大于0.1NA | |
| C. | 78g Na2O2与足量CO2完全反应,转移的电子总数为NA | |
| D. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3 molI2,则转移6NA个电子 |
分析 A、求出甲基的物质的量,然后根据1mol甲基中含9mol电子来分析;
B、硫离子的水解导致阴离子个数增多;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠反应时转移1mol电子来分析;
D、KIO3+6HI=KI+3I2+3H2O反应转移5mol电子,生成3mol碘单质.
解答 解:A、1.5g甲基的物质的量为0.1mol,而1mol甲基中含9mol电子,故0.1mol甲基中含0.9mol电子即0.9NA个,故A正确;
B、硫离子的水解导致阴离子个数增多,故溶液中的阴离子的个数多于0.1NA个,故B正确;
C、78g过氧化钠的物质的量为1mol,而1mol过氧化钠反应时转移1mol电子,即NA个,故C正确;
D、KIO3+6HI=KI+3I2+3H2O反应转移5mol电子,生成3mol碘单质,故当生成3mol碘单质时,转移5NA个电子,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 若二者恰好中和,则一定是 a=b | B. | 若混合液显碱性,则一定是 b≥a | ||
| C. | 若混合液显中性,则一定是 a≤b | D. | 若混合液显酸性,则一定是 a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 | |
| B. | 2mL10%的NaOH溶液中滴加2%的CuSO4溶液4~6滴制得新制氢氧化铜 | |
| C. | 将水蒸气通过灼热的铁粉,铁粉变红棕色,说明铁与水在高温下能发生反应 | |
| D. | 取a克Na2CO3和NaHCO3混合物与少量稀盐酸充分反应,加热、蒸干、灼烧至熔化,冷却得b克固体,可测得Na2CO3质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
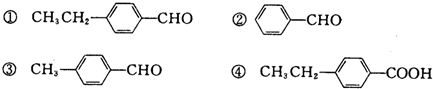
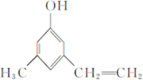 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
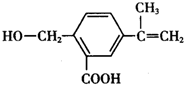 ,关于有机物M的叙述正确的是( )
,关于有机物M的叙述正确的是( )| A. | 有机物M的分子式为C11H14O3 | |
| B. | 1 molNa2CO3最多能消耗1 mol有机物M | |
| C. | 有机物M能发生取代、氧化、还原和加聚反应 | |
| D. | 有机物M能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的单质在自然界只有一种核素 | |
| B. | E的单质与任何物质反应,都只表现氧化性 | |
| C. | 元素C、D、E的原子中,原子半径依次减小 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 1 L浓度为1 mol•L-1的 H2O2水溶液中含有的氧原子数为2NA | |
| D. | MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+3m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$(A-Z+2m)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com