
分析 (1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,则分子中B原子杂化轨道数目为3,其晶体具有与石墨相似的层状结构,其同层分子间的主要作用力是氢键;
(2)Na[B(OH)4]中所含化学键类型有阳离子与银离子间的离子键,內界中B为中心离子,提供空轨道,OH-提供孤电子对,形成配位键,O-H键为极性键,根据价层电子对互斥理论模型计算银离子的空间构型.
解答 解:(1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,则分子中B原子杂化轨道数目为3,分子中B原子杂化轨道的类型是,其晶体具有与石墨相似的层状结构,其同层分子间的主要作用力是氢键,
故答案为:sp2;氢键;
(2)Na[B(OH)4]中所含化学键类型有阳离子与银离子间的离子键,內界中B为中心离子,提供空轨道,OH-提供孤电子对,形成配位键,O-H键为极性键,根据价层电子对互斥理论模型,西格玛电子对数=4,孤电子对数为0,故离子的空间构型为正四面体,
故答案为:离子键、配位键和极性键;正四面体.
点评 本题是对物质结构与性质的考查,涉及化学键、微粒结构、杂化方式、氢键、晶胞结构与计算等,注意识记中学常见知识结构,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液不能用带磨口玻璃塞的玻璃瓶盛放 | |
| B. | CO2与水反应生成碳酸,是酸性氧化物;SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2═Si+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
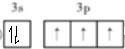 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).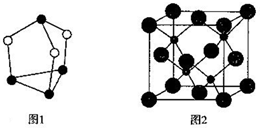
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油里含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含有C18以上的烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油的分馏是一个物理过程,而裂化及裂解属于化学过程 | |
| D. | 石油裂解的惟一目的是获得乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、HCl、HF | B. | K、Mg、Na | ||
| C. | MgO、NaCl、KBr | D. | 晶体硅、碳化硅、金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氧为32g | |
| B. | 摩尔是物质的量的单位 | |
| C. | 44gCO2的体积为22.4L | |
| D. | 2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有氧化性 | B. | 具有还原性 | C. | 具有漂白性 | D. | 含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com