
【题目】A.【物质结构与性质】
甲基呋喃与氨在高温下反应得到甲基吡咯:

![]()
(1)Zn的基态原子核外电子排布式为______________。
(2)配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是_____________(填元素符号)。
(3)1 mol甲基呋喃分子中含有σ键的数目为_______________mol。
(4)甲基吡咯分子中碳原子轨道的杂化轨道类型是____________。与NH3分子互为等电子体的阳离子为_____________。
(5)甲基吡咯的熔沸点高于甲基呋喃的原因是____________。
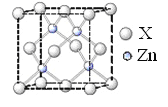
(6)锌的某种化合物晶胞结构如图所示,则构成该化合物的两种粒子个数比为____________
B.【实验化学】
硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。

已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙的冷凝管中冷凝水的入口是_____________(填“a”或“b”),装置己的作用是____________;如何控制两种反应物体积相等:______________。
(2)装置戊上方分液漏斗中最好选用下列试剂:_____________(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是_____________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H![]() SO2Cl2 + H2SO4,分离两种产物的方法是____________(选填字母)。
SO2Cl2 + H2SO4,分离两种产物的方法是____________(选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
【答案】 [Ar]3d104s2 N和O 12 sp3和sp2 H3O+ 甲基吡咯分子间存在氢键 1︰1 a 吸收尾气并防止空气中的水蒸气进入装置丙 通过调节旋塞或滴液的快慢控制气体流速,使装置乙和丁导管口产生气泡的速度相等 B Cl2+SO2+2H2O==2HCl+H2SO4 C
【解析】A.本题主要考查分子结构。
(1)Zn的基态原子核外电子排布式为[Ar]3d104s2。
(2)配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是N和O。
(3)分子中每两个相邻原子之间存在一个σ键,1 mol甲基呋喃分子中含有σ键的数目为12mol。
(4)甲基吡咯分子中单键碳原子杂化轨道类型是sp3,双键碳原子杂化轨道类型是sp2,总之,碳原子轨道的杂化轨道类型是sp3和sp2。等电子体是原子数相同、价电子总数相同的微粒,与NH3分子互为等电子体的阳离子为H3O+。
(5)甲基吡咯的熔沸点高于甲基呋喃的原因是甲基吡咯分子间存在氢键。
(6)晶胞含有4个Zn、4个X,则构成该化合物的两种粒子个数比为1:1。
B.本题主要考查对于制取硫酰氯探究实验的评价。
(1)冷凝水的流向是“下进上出”,所以装置丙的冷凝管中冷凝水的入口是a,装置己的作用是吸收尾气并防止空气中的水蒸气进入装置丙;如何控制两种反应物体积相等:通过调节旋塞或滴液的快慢控制气体流速,使装置乙和丁导管口产生气泡的速度相等。
(2)A.蒸馏水可以溶解氯气;B.饱和食盐水溶解氯气的能力很小;C.浓氢氧化钠溶液与氯气发生反应;D.6.0 molL1盐酸挥发逸出杂质气体氯化氢。故选B。
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是Cl2+SO2+2H2O==2HCl+H2SO4。
(4)两种产物都呈液态,且沸点差别较大,故选C。


科目:高中化学 来源: 题型:
【题目】下列可以大量共存的离子组是( )
A. 无色透明溶液中:NH4+、Cu2+、Cl﹣、NO3﹣
B. 碱性溶液中:K+、Na+、SO42﹣、Cl﹣
C. 酸性溶液中:K+、Na+、HCO3﹣、Ca2+
D. 酸性溶液中:Na+、Fe2+、SO42﹣、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 常温常压下,1 g H2在足量Cl2中燃烧生成HCl,放出92.3 kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)2HCl(g) ΔH=+184.6 kJ·mol-1
B. 甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量
D. 相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。

已知:①NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl;
②二氧化氯极易溶于水。
(1)装置A中NaClO3和Na2SO3制备ClO2气体,其物质的量的理论比值为____________;该装置中采用浓硫酸而不用稀硫酸的原因是___________。
(2)装置B的作用是 _____________;装置C中反应为放热反应,在不改变反应物浓度和体积的条件下,为了使反应在低温下进行,实验中可采取的措施是________________。
(3)写出装置C发生的离子方程式______________。
(4)从装置C反应后的溶液获得干燥的NaClO2晶体的操作步骤为:将装置C中的液体取出在减压和55℃条件下蒸发,至出现大量晶体后,___________________(填实验步骤)。(已知:NaClO2晶体易溶于水,难溶解于乙醇等有机溶剂。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJmol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJmol﹣1
H2O(g)═H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①已知该反应能自发进行,则△H____0(填“大于”、“小于”或“等于”)
②如图,t2时CO2的转化率=_____________

(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质
都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)______K(Ⅱ)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(Ⅰ)______c(Ⅱ).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=______,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡______移动(填“正向”、“逆向”或“不”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中,不能说明反应:C(s) +CO2(g)![]() 2CO(g)已达到平衡状态的是
2CO(g)已达到平衡状态的是
A. 每消耗1 mol CO2的同时生成2 mol CO
B. 混合气体的平均相对分子质量不再改变
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的浓度由0.07molL﹣1降到0.05molL﹣1所需的反应时间( )
A.等于5s
B.等于10s
C.小于10s
D.大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车、飞机等交通工具排放的尾气中含有的大量CO、NO 等大气污染物,是造成雾霾天气的主要原因,研究CO、NO 的转化对于环境的改善有重大意义。
(1)有人设想将CO按下列反应除去:2CO(g)=2C(s) +O2(g) △H>0。你认为该设想能否实现并说明理由:__________________________。
(2)用活性炭还原法可以处理汽车尾气中的氮氧化物。某研究小组在2 L的恒容密闭容器中加人0.100 mL NO 和2.030 mol固体活性炭,发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表:
T/℃ | n(固体活性炭)/mol | n(NO)/mol | n(N2)/mol | n(CO2)/mol |
200 | 2.000 | 0.040 | 0.030 | 0.030 |
350 | 2.005 | 0.050 | 0.025 | 0.025 |
①该反应的正反应为___________(填“吸热”或“放热”)反应。
②200℃时,反应达到平衡后向恒容容器中再充入0.100 mol NO,再次达到平衡后,混合气中NO的百分含量将__________(填“增大”“减小”或“不变”)。
③上述反应在350℃时的平衡常数K=_______________。
(3)在密闭容器中发生上述反,,达到平衡时,下列措施能提高NO转化率的是___________(填字母)。
A.选用更高效的催化剂 B.增加C(s)的量
C.降低反应体系的温度 D.缩小容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖被授予白川英树等三位科学家,以表彰他们在导电聚合物这一领域所做的开创性工作,他们发现含…-CH=CH-CH=CH-CH=CH-…这种结构的聚合物具有导电性,合成上述这种结构聚合物的物质是( )
A.乙炔B.乙烯C.丁烯D.乙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com