
| A. | (a+b)×63g | B. | (a+b)×169g | C. | [Vc-$\frac{9a+b}{3}$]mol | D. | (a+b)mol |
分析 分情况讨论:
1、当硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,根据铁离子的物质的量计算未被还原的硝酸的物质的量即可;
2、当硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,根据氧化还原反应中得失电子守恒计算被还原的硝酸,硝酸总量-被还原的硝酸=未被还原的硝酸.
解答 解:若硝酸恰好反应时,amolFeS与bmolFeO被氧化生成Fe(NO3)3,由铁原子守恒可知铁原子和硝酸的关系式为amolFeS+bmolFeO→(amol+bmol)Fe→(amol+bmol)Fe(NO3)3→3(amol+bmol)HNO3,所以未被还原的硝酸的质量=3(amol+bmol)×63g/mol=(a+b)×189g;
若硝酸过量时,amolFeS与bmolFeO生成Fe(NO3)3和H2SO4失去的电子数=amol[(3-2)+(6-(-2))]+bmol(3-2)=(9a+b)mol,氧化还原反应中得失电子数相等,所以硝酸得到(9a+b)mol电子生成一氧化氮,一个硝酸分子得到3个电子生成NO,所以被还原的硝酸的物质的量=$\frac{(9a+b)}{3}$mol,未被还原的硝酸的物质的量=(Vc-$\frac{9a+b}{3}$)mol,
故选C.
点评 本题考查了有关氧化还原反应的计算,为高频考点,题目难度较大,明确该题要分情况讨论是解本题的关键,注意本题要结合原子守恒和得失电子守恒进行分析解答.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
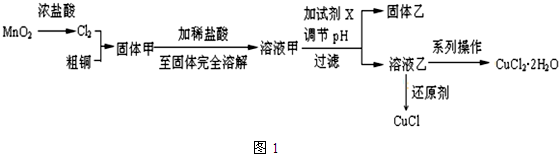
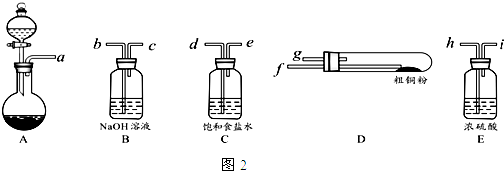
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数的数值与12g 12C所含的碳原子数相等 | |
| B. | 在0.5mol Na2SO4 中,含有的Na+ 数约是6.02×1023 | |
| C. | 等物质的量的O2 与O3,所含氧原子数相等 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
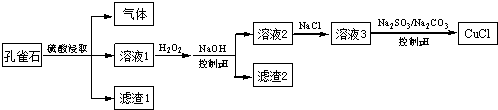
| A. | H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 | |
| B. | SO32-将溶液3中的Cu2+还原,反应得到CuCl | |
| C. | CO32-作用是控制溶液pH,促使CuCl沉淀的生成 | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
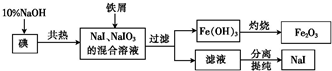
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com