
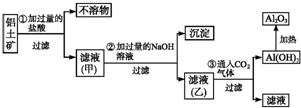
 工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示:分析 铝土矿加过量盐酸溶解,Fe3O4、Al2O3和HCl反应溶解,反应方程式分别为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀为不溶物SiO2;滤液甲中含有的阳离子有Fe3+、Fe2+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子、亚铁离子和氢氧化钠反应生成氢氧化铁沉淀、氢氧化亚铁,最终生成氢氧化铁,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀的成分是氢氧化铁;滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,以此解答该题.
解答 解;铝土矿加过量盐酸溶解,Fe3O4、Al2O3和HCl反应溶解,反应方程式分别为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,所以沉淀为不溶物SiO2;滤液甲中含有的阳离子有Fe3+、Fe2+、Al3+、H+,加入过量烧碱,氢离子和氢氧化钠反应生成水,铁离子、亚铁离子和氢氧化钠反应生成氢氧化铁沉淀、氢氧化亚铁,最终生成氢氧化铁,生成的氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以沉淀的成分是氢氧化铁;滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝沉淀加热可以得到氧化铝,即2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
(1)由以上分析可知不溶物为SiO2,滤液甲中的溶质为FeCl3、FeCl2、AlCl3、HCl,故答案为:SiO2;FeCl3、FeCl2、AlCl3、HCl;
(2)滤液甲中含铝元素的溶质与过量NaOH溶液反应进入滤液乙,反应的离子方程式为Al3++4OH-=AlO2-+2H2O,发生此反应的反应物的物质的量之比为1:4,氢氧化铝与强碱反应,不溶于氨水,
故答案为:1:4;否;
(3)滤液甲含有Fe3+,具有氧化性,可与碘离子发生氧化还原反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,从该溶液中获得碘单质需要加入四氯化碳进行萃取,然后分液、蒸馏可得到碘,
故答案为:2Fe3++2I-=2Fe2++I2;四氯化碳;分液;
(4)滤液乙中含有偏铝酸钠和氯化钠,通入过量的二氧化碳可以得到碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-;
(5)若将铝土矿用过量氢氧化钠溶液溶解,含有偏铝酸钠、硅酸钠,过滤后向滤液中通入过量CO2,可生成氢氧化铝、硅酸沉淀,加热分解生成Al2O3、SiO2,
故答案为:Al2O3、SiO2;
(6))②步骤得到的沉淀为灰绿色,沉淀变为红褐色需要较长时间,欲快速得到红褐色沉淀,应加入具有强氧化性和碱性的物质,只有过氧化钠符合,
故答案为:A.
点评 本题以工艺流程题形式考查铝的化合物的性质、物质的分离提纯、以及化学用语书写等,为高考常见题型,侧重于学生的分析能力和实验能力的考查,难度中等,清楚工艺流程原理是关键,是对知识迁移的综合运用.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
| 空硬质玻璃管质量 | 硬质玻璃管与镁的质量 | 硬质玻璃管与产物的质量 |
| 142.312g | 142.480g | 142.550g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+可能存在 | |
| B. | 若焰色反应测得K+存在,则NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量的NaOH固体,Na2S溶液中的c(Na+)、c(S2-)均增大 | |
| B. | Na2S溶液中存在着:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | Na2S溶液中离子浓度关系为:c(Na+)>c(OH-)>c(S2-)>c(H+) | |
| D. | Na2S溶液中存在着:2c(Na+)=c(S2-)+c(HS-)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | X、Z、W元素的原子半径以及它们的气态氢化物的热稳定性均依次递增 | |
| B. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| C. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 | |
| D. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
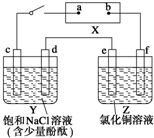 如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图中X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水制取氢氧化铝 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com