
向X的溶液中,加入Y试剂,产生的沉淀示意图如图所示情形的是(注意线段的斜率)( )
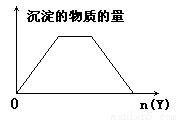
A.向NaOH和Ca(OH)2的混合液中通入CO2
B.向HCl和AlCl3的混合液中滴加NaOH
C.向NH4Cl和AlCl3的混合液中滴加NaOH
D.向含NaOH的NaAlO2溶液中滴加盐酸
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO3-、K+ | 稀硫酸 | 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
C | Ba2+、HCO3-、Cl- | 氢氧化钠溶液 | HCO3-+ OH-=CO32-+H2O |
D | Al3+、Cl-、NO3- | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列有关说法正确的是
A.SO2具有氧化性,可用于漂白纸浆
B . 医用消毒酒精中乙醇的浓度为95%
C.用灼烧的方法可以区分蚕丝和人造纤维
D.硅胶作袋装食品的干燥剂时发生了化学变化
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
有100 mL 3.5 mol·L-1的NaOH溶液和100 mL 1 mol/L的AlCl3溶液,按如下两种方法进行实验:
①将NaOH溶液分多次加入到AlCl3溶液中(边加边搅拌);
②将AlCl3溶液分多次加入到NaOH溶液中(边加边搅拌)。
比较两次实验的结果,其中正确的是( )
A.现象相同,沉淀量相等 B.现象不同,沉淀量不等
C.现象相同,沉淀量不等 D.现象不同,沉淀量相等
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为( )
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
1 mol Na2O2晶体和1 mol Na2O的晶体中阴离子的个数比较,前者和后者的关系是( )
A.前者大 B.前者小 C.相等 D.不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C-O | O-H | C-H |
| 键能(kJ•mol-1) | 498 | 351 | 465 | 413 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com