
【题目】乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸,其K1=5.4×10-2,K2=5.4×10-5,已知碳酸的K1=4.4×10-7,K2=4.7×10-11,
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9,试回答下列问题:
(1)0.1mol/LNa2CO3溶液的pH_________0.1mol/LNa2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。
(2)下列化学方程式正确的是_______(填选项序号)
A. H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
(3)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。 实验步骤:准确以1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL.
(已知:5H2C2O4+2KMnO4+3H2SO4===10CO2↑+2MnSO4+K2SO4+8H2O)
①高锰酸钾溶液应装在_________滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________。
③计算样品中Na2C2O4的纯度是_______________________。
(4)草酸钙结石是五种肾结石里最为常见的一种.患草酸钙结石的病人多饮白开水有利于结石的消融.请用化学用语和简要的文字说明其原因:______.
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入cmol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______.
【答案】 大于 B 酸式 滴入最后一滴高锰酸钾溶液,溶液由无色变为紫色且半分钟不褪色(浅紫色或紫红色) 67% 草酸钙存在溶解沉淀平衡,CaC2O4(s)Ca2+(aq)+C2O42-(aq),多饮白开水,导致c(Ca2+)、c(C2O42-)减小,使平衡向右移动,有利于CaC2O4的溶解, 3.2×10-3
【解析】试题分析:本题考查电离平衡常数的应用,氧化还原滴定,影响溶解平衡的因素以及溶度积的计算。
(1)乙二酸的K2(5.4×10-5)![]() 碳酸的K2(4.7×10-11),根据越弱越水解,CO32-的水解能力强于C2O42-,则0.1mol/LNa2CO3溶液的pH大于0.1mol/LNa2C2O4溶液的pH。
碳酸的K2(4.7×10-11),根据越弱越水解,CO32-的水解能力强于C2O42-,则0.1mol/LNa2CO3溶液的pH大于0.1mol/LNa2C2O4溶液的pH。
(2)由题目提供的电离平衡常数的数值知,酸性:H2C2O4![]() HC2O4-
HC2O4-![]() H2CO3
H2CO3![]() HCO3-,根据强酸制弱酸的复分解反应规律,A项,离子方程式为H2C2O4(少量)+2CO32-=C2O42-+2HCO3-或2H2C2O4+CO32-(少量)=2HC2O4-+H2O+CO2↑,错误;B项,HC2O4-(少量)+CO32-=HCO3-+C2O42-或2HC2O4-+CO32-(少量)=H2O+CO2↑+2C2O42-,正确;C、D项,不遵循强酸制弱酸的原则,错误;答案选B。
HCO3-,根据强酸制弱酸的复分解反应规律,A项,离子方程式为H2C2O4(少量)+2CO32-=C2O42-+2HCO3-或2H2C2O4+CO32-(少量)=2HC2O4-+H2O+CO2↑,错误;B项,HC2O4-(少量)+CO32-=HCO3-+C2O42-或2HC2O4-+CO32-(少量)=H2O+CO2↑+2C2O42-,正确;C、D项,不遵循强酸制弱酸的原则,错误;答案选B。
(3)①高锰酸钾溶液具有强氧化性,能腐蚀橡胶管,高锰酸钾溶液不能装在碱式滴定管中,应装在酸式滴定管中。
②由于KMnO4溶液本身有颜色,实验中无需其他指示剂,滴定至终点时的实验现象是:滴入最后一滴高锰酸钾溶液,溶液由无色变为紫色且半分钟不褪色(浅紫色或紫红色)。
③n(KMnO4)=0.016mol/L![]() 0.025L=0.0004mol,则20.00mL溶液中n(Na2C2O4)=
0.025L=0.0004mol,则20.00mL溶液中n(Na2C2O4)=![]() n(KMnO4)=0.001mol,100mL溶液中Na2C2O4物质的量为0.005mol,Na2C2O4的质量为0.005mol
n(KMnO4)=0.001mol,100mL溶液中Na2C2O4物质的量为0.005mol,Na2C2O4的质量为0.005mol![]() 134g/mol=0.67g,样品中Na2C2O4的纯度是
134g/mol=0.67g,样品中Na2C2O4的纯度是![]() 100%=67%。
100%=67%。
(4)草酸钙在溶液中存在沉淀溶解平衡,CaC2O4(s)![]() Ca2+(aq)+C2O42-(aq),多饮白开水,导致c(Ca2+)、c(C2O42-)减小,使平衡向右移动,有利于CaC2O4的溶解。
Ca2+(aq)+C2O42-(aq),多饮白开水,导致c(Ca2+)、c(C2O42-)减小,使平衡向右移动,有利于CaC2O4的溶解。
(5)Ksp(CaCO3)=2.5![]() 10-9,则碳酸钙饱和溶液中c(Ca2+)=c(CO32-)=
10-9,则碳酸钙饱和溶液中c(Ca2+)=c(CO32-)=![]() mol/L=5
mol/L=5![]() 10-5mol/L;向20mL碳酸钙的饱和溶液中加入20mL草酸钾溶液后c(Ca2+)=2.5
10-5mol/L;向20mL碳酸钙的饱和溶液中加入20mL草酸钾溶液后c(Ca2+)=2.5![]() 10-5mol/L,要产生草酸钙沉淀,混合后溶液中c(C2O42-)
10-5mol/L,要产生草酸钙沉淀,混合后溶液中c(C2O42-)![]() 4.0
4.0![]() 10-8
10-8![]() (2.5
(2.5![]() 10-5)=1.6
10-5)=1.6![]() 10-3mol/L,则等体积混合前草酸钾溶液物质的量浓度c最小为3.2
10-3mol/L,则等体积混合前草酸钾溶液物质的量浓度c最小为3.2![]() 10-3mol/L。
10-3mol/L。


科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③5.6g CH4 ④0.5mol HCl,下列关系正确的是( )
A.体积大小:④>③>①>②
B.原子数目:③>①>④>②
C.密度大小:④>②>③>①
D.质量大小:④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是
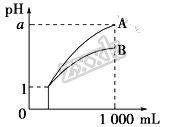
①若a<4,则A、B都是弱酸 且电离平衡常数K(A)<K(B)
②稀释后,B酸溶液的酸性比A酸溶液强
③若a=4,则A是强酸,B是弱酸
④稀释前A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A,B,C三种化合物,各取40g相混合,完全反应后,得18g B,49g C,还有D生成.已知D的相对分子质量为106.现将80g A和33g B反应,能生成D( )
A.1 mol
B.0.5 mol
C.0.75 mol
D.0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制350mL1.0mol/LH2SO4溶液,需用98%的浓硫酸溶液(ρ=1.84g/L)体积为多少?取25mL1.0mol/LH2SO4溶液与2g锌粉充分反应,产生标准状况下H2多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某KNO3溶液A中,混有少量的Ca2+和SO42﹣等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体. 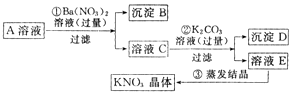
根据上述回答:
(1)沉淀D中所含有的物质是
(2)按上述实验方案制得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第步(填 ①②③)可能有误,请加以改正: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 . 某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验. 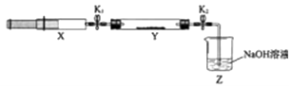
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质R完全燃烧的化学方程式为:2R+3O2 ![]() 2CO2+4H2O有关该反应,有下列说法:
2CO2+4H2O有关该反应,有下列说法:
①R一定含碳、氢两种元素,可能含有氧元素
②R中碳元素的质量分数是37.5%
③6.4g R完全燃烧,转移1.2NA个电子
④R的摩尔质量为32,若6.4g R完全燃烧生成8.8g CO2 ,
则正确的一组是( )
A.①②
B.③④
C.②④
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com