
分析 Ⅰ.已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)据此计算;
Ⅱ.(1)①根据v=$\frac{△c}{△t}$计算v(SO2);
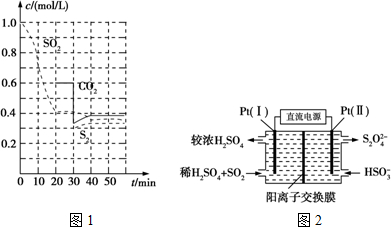
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度;
③平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,注意固体和纯液体不写入表达式;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠;
②a.根据电荷守恒判断;
b.根据物料守恒判断;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,根据电子转移守恒计算生成硫酸根、氢离子的物质的量,为保持溶液电中性,多余的氢离子通过阳离子交换膜移至右侧,左侧溶液中增加离子为生成硫酸电离的离子总量.
解答 解:Ⅰ.已知①BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
②BaS(s)=Ba(s)+S(s)△H=+460kJ?mol-1
③2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,
根据盖斯定律:③×2-①-②得方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=(-221)×2-(+460)-(+571.2)=-1473.2KJ•mol-1,
故答案为:-1473.2KJ•mol-1;
Ⅱ.(1)①由图可知,0-20min内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故v(SO2)=$\frac{0.60mol/L}{20min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min);
②30min时瞬间,二氧化碳浓度降低,S2的浓度不变,而后二氧化碳、S2的浓度均增大,应是减少CO2的浓度,故答案为:减少CO2的浓度;
③恒温恒容时2C(s)+2SO2(g)?S2(g)+2CO2(g),平衡常数K=$\frac{c({S}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(S{O}_{2})}$,
故答案为:$\frac{c({S}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(S{O}_{2})}$;
(2)①Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32-+SO2+H2O=2HSO3-,故答案为:SO32-+SO2+H2O=2HSO3-;
②a.根据电荷守恒:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),故a正确;
b.溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),故b正确;
c.NaHSO3溶液中HSO3-的电离程度大于其水解程度,故溶液中c(Na+)>c(HSO3-)>c(H+)>c(SO32-),故c正确;
d.水电离出氢离子浓度等于溶液中氢氧根离子浓度,由于NaHSO3溶液的pH未知,不能计算水电离出氢离子浓度,故d错误,
故答案为:abc;
(3)①由图可知,Pt(1)电极上二氧化硫被氧化生成硫酸,电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,
故答案为:SO2-2e-+2H2O=SO42-+4 H+;
②左侧电极反应式为:SO2-2e-+2H2O=SO42-+4 H+,根据电子转移守恒,生成硫酸根物质的量$\frac{0.02mol}{2}$=0.01mol,生成氢离子为0.04mol,为保持溶液电中性,0.01mol硫酸根需要0.02mol氢离子,多余的氢离子通过阳离子交换膜移至右侧,即有0.02mol氢离子移至右侧,故左侧溶液中增加离子为0.01mol+0.02mol=0.03mol,
故答案为:0.03.
点评 本题属于拼合型题目,涉及反应热计算、反应速率计算、化学平衡影响因素、离子浓度比较、电极反应式书写、电解池有关计算等,需要学生具备扎实的基础,侧重考查学生对知识的迁移应用,(3)中左侧溶液中增加离子物质的量计算为易错点,学生容易根据电极反应式计算,忽略部分氢离子移至右侧,题目难度中等.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
 |  |  |  |
| 防治高血压 | 防治缺铁性贫血 | 做甜味剂 | 做防腐剂 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,在恒容密闭容器中充入等体积的X、Y气体,发生反应X(g)+Y(g)?2Z(g),一段时间后达到平衡,其他条件不变,再充入0.3mol Z,平衡时Y的体积分数增大 | |
| B. | 碱性锌锰干电池工作过程中,每通过2mol电子,负极质量减轻130g | |
| C. | 通过测定CH3COONa溶液和NaHS溶液的pH,可以比较醋酸和氢硫酸酸性的强弱 | |
| D. | 将MgCl2、Mg(OH)2、MgCO3三种物质与水混合,加热、灼烧,最终的固体产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2属于危险化学品,其标识应为: | |
| B. | 当你走进化学实验室之前,应认真阅读实验室的安全守则 | |
| C. | 中国大陆的火警报警电话为“119”,香港、澳门为“999” | |
| D. | 一般情况下,金属类物质着火时不宜使用二氧化碳类灭火器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1mol/L的FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com