
【题目】最新研究表明As2O3在医药领域有重要应用。某小组从工业废料中提取As2O3设计流程如下:
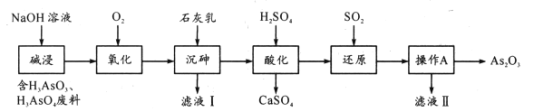
已知:H3AsO3为弱酸,热稳定性差。
(1)写出一条“碱浸”时提高浸取率的方法____;“碱浸”中H3AsO3转化成Na3AsO3的离子方程式为____。
(2)“氧化”时常在向混合液中通入O2时对体系加压,目的是____。
(3)“沉砷”过程中有如下反应:
①![]()
![]() <0
<0
②![]()
![]() >0
>0
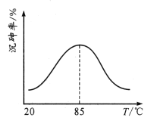
沉砷率与温度关系如图。沉砷最佳温度为____,高于85℃时,沉砷率下降的原因是____。
(4)“还原”过程中获得H3 AsO3的化学反应方程式为____;“操作A”为:____、过滤;滤液Ⅱ的主要成分是____。
(5)若每步均完全反应,“氧化’’和“还原”时消耗相同条件下O2和SO2体积分别为xL、yL,则废水中n(H3AsO3):n(H3AsO4)=____(写出含x、y的计算式)。
【答案】搅拌或多次浸取 H3AsO3+3OH-=AsO33-+3H2O 增大O2溶解度,加快反应速率 85℃ 高于85℃,随着温度升高,反应①中c(Ca2+)、c(OH)减小,温度对平衡移动的影响①大于②,使反应②中平衡逆向移动,Ca5(OH)(AsO4)3沉淀率下降 H3AsO4+H2O+SO2= H3AsO3+H2SO4 加热 H2SO4 2x:(y-2x)
【解析】
工业废料(H3AsO3、H3AsO4含废料)加入氢氧化钠溶液碱浸,与氢氧化钠反应生成Na3AsO3、Na3AsO4溶液,通入氧气氧化Na3AsO3溶液为Na3AsO4溶液,向溶液中加入石灰乳,得到为Ca5(OH)(AsO4)3沉淀,将Ca5(OH)(AsO4)3用硫酸酸化得到H3AsO4,通入二氧化硫与H3AsO4溶液混合:H3AsO4+H2O+SO2= H3AsO3+H2SO4,还原后加热溶液,H3AsO3分解为As2O3,据此分析解答。
(1)反应物接触时间越长,反应越充分,所以“碱浸”时可采用搅拌或多次浸取使其充分反应,提高原料浸取率;H3AsO4与氢氧化钠反应为酸碱中和反应,离子方程式为H3AsO3+3OH-=AsO33-+3H2O;
故答案为:搅拌或多次浸取;H3AsO3+3OH-=AsO33-+3H2O;
(2)“氧化”时向混合液中通入O2时对体系加压可以增大O2溶解度,加快反应速率。
故答案为:增大O2溶解度,加快反应速率;
(3)“沉砷”是将砷元素转化为Ca5(OH)(AsO4)3沉淀,发生的主要反应有:①Ca(OH)2(s)Ca2+(aq)+2OH-(aq)△H<0;②5Ca2++OH-+3AsO43- Ca5(OH)(AsO4)3 △H>0,高于85℃,随着温度升高,反应①中c(Ca2+)、c(OH)减小,温度对平衡移动的影响①大于②,使反应②中平衡逆向移动,Ca5(OH)(AsO4)3沉淀率下降;
故答案为:高于85℃,随着温度升高,反应①中c(Ca2+)、c(OH)减小,温度对平衡移动的影响①大于②,使反应②中平衡逆向移动,Ca5(OH)(AsO4)3沉淀率下降;
(4)“还原”过程中二氧化硫将H3AsO4还原为H3AsO3,自身被氧化生成硫酸,反应为:H3AsO4+H2O+SO2= H3AsO3+H2SO4;还原后加热溶液,H3AsO3分解为As2O3,所以“操作A”为:加热、过滤;由方程式可知,滤液Ⅱ的主要成分是H2SO4。
故答案为:H3AsO4+H2O+SO2= H3AsO3+H2SO4;加热;H2SO4;
(5)“氧化’’过程中Na3AsO3溶液氧化为Na3AsO4溶液,关系式为2H3AsO3~2Na3AsO3 ~O2;“还原”过程中二氧化硫将H3AsO4还原为H3AsO3,关系式为H3AsO4 ~SO2;
已知消耗相同条件下O2和SO2体积分别为xL、yL,体积比等于物质的量之比,即n(O2):n(SO2)=x:y,由关系式可知,n(H3AsO3)=2n(O2),则废水中原有的n(H3AsO4)=y-2x,
则废水中n(H3AsO3):n(H3AsO4)=![]() =2x:(y-2x)。
=2x:(y-2x)。
故答案为:2x:(y-2x)。


科目:高中化学 来源: 题型:
【题目】ⅡBⅥA族半导体纳米材料(如CdTe、CdSe、ZnSe、ZnS等)在光电子器件、太阳能电池以及生物探针等方面有广阔的前景。回答下列问题:
(1)基态锌(Zn)原子的电子排布式为[Ar]_____。
(2)“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是______(填标号)
a 构造原理 b 泡利原理 c 洪特规则 d 能量最低原理
(3)在周期表中,Se与As、Br同周期相邻,与S、Te同主族相邻。Te、As、Se、Br的第一电离能由大到小排序为_______。
(4)H2O2和H2S的相对分子质量相等,常温下,H2O2呈液态,而H2S呈气态,其主要原因是______;![]() 的中心原子杂化类型为_______,其空间构型为_______。
的中心原子杂化类型为_______,其空间构型为_______。
(5)ZnO具有独特的电学及光学特性,是一种应用广泛的功能材料。
①已知锌元素、氧元素的电负性分别为1.65、3.5,ZnO中化学键的类型为______。ZnO可以被NaOH溶液溶解生成[Zn(OH)4]2—,请从化学键角度解释能够形成该离子的原因。_______。

②一种ZnO晶体的晶胞如图所示。晶胞边长为a nm、阿伏加德罗常数的值为NA,其晶体密度为________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸(H2MA,Ka1=1.4×10-3;Ka2=1.7×10-5)是一种安全的食品保鲜剂,H2MA分子比离子更易透过细胞膜而杀灭细菌。常温下,向20 mL 0.2 mol/L H2MA溶液中滴加0.2mol/L NaOH溶液。根据图示判断,下列说法正确的是
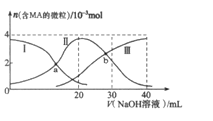
A. b点比a点杀菌能力强
B. 曲线Ⅲ代表HMA-物质的量的变化
C. MA2-水解常数Kh≈7.14×10-12
D. 当V=30 mL时,溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题。
(1)实验室中少量的钠通常保存在____中,在实验室中取用钠的仪器是_____。
(2)将金属钠投入水中,发生反应的离子方程式为______________________。
(3)该同学在实验室欲配制500mL 0.1mol/L NaOH溶液。
①配制溶液时肯定不需要如下图所示仪器中的_____________(填字母),配制上述溶液还需要用到的玻璃仪器是_____________(填仪器名称)。

②配制溶液时有如下操作:a.溶解 b.摇匀 c.洗涤 d.冷却 e.称量 f.将溶液移至容量瓶g.定容,实验操作顺序正确的是________。
a. e→a→f→d→c→f→g→b b. e→a→d→f→c→f→g→b
c. e→a→f→d→c→f→b→g d. e→a→d→f→c→f→b→g
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L。下列操作会引起所配浓度偏大的是______。
a.烧杯未进行洗涤
b.配制前,容量瓶中有少量蒸馏水
c.往容量瓶转移时,有少量液体溅出
d.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
e.在容量瓶中定容时俯视容量瓶刻度线
f.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
④为中和100mL 2.3 mol·L-1 稀硫酸后显中性,需要加入______L 0.1mol/L NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为:CuSO45H2O(s)=CuSO4(s)+5H2O(l) ΔH=+Q1kJ·mol-1;室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2kJ,则()
A. Q1>Q2 B. Q1=Q2 C. Q1<Q2 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:

下列说法不正确的是
A. 装置②中试剂可以是NaOH溶液
B. 装置③的作用是干燥O2
C. 收集氧气应选择装置a
D. 装置②、③之间应增加盛澄清石灰水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验现象的说法不正确的是
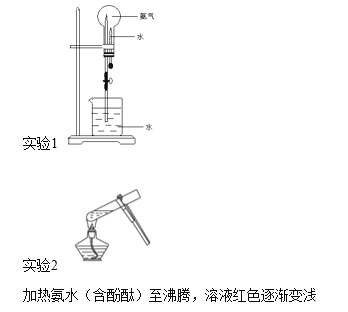
A. 氨气是无色有刺激性气味的气体,密度比空气小
B. 实验1,由喷泉现象可知氨气极易溶于水且溶解速率快
C. 实验1,烧瓶溶液中的含氮微粒有:NH3、NH3·H2O和NH4+
D. 实验2,加热过程中温度和c(NH3·H2O)对NH3·H2O电离平衡移动方向的影响一致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒温恒容装置中进行合成氨反应(正反应为放热反应),各组分浓度—时间图象如下。

①表示N2浓度变化的曲线是____(填序号)。
②前25 min内,用H2浓度变化表示的化学反应速率是____。该温度下该反应的平衡常数为____。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是____(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(3)电厂烟气脱氮:主反应为①4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。
5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是____________________,导致这种规律的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃烧产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请写出下列物质反应的化学方程式。
(1)X在一定条件下与氧气反应____________________________________;
(2)Y与氢氧化钠溶液的反应______________________________________;
(3)Z与水的反应________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com