
| A、10min内NO浓度变化表示的速率v(NO)=0.01 mol?L-1?min-1 |
| B、若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于α |
| C、若升高温度,平衡逆向移动,则该反应的△H>0 |
| D、若起始时向容器中充入NO2(g) 0.1 mol、NO(g)0.2 mol和Cl2(g)0.1 mol(固体物质足量),则反应将向逆反应方向进行 |
| △c |
| △t |
(
| ||||
(
|
| △c |
| △t |
| ||
| 10 |
(
| ||||
(
|


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
| A、铜片加入稀硝酸中:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O |
| B、向小苏打溶液中加入醋酸:HCO3-+H+═CO2↑+H2O |
| C、向HI溶液中加入Fe(OH)3固体:Fe(OH)3+3H═Fe3++3H2O |
| D、向MgSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlO2-,K+,SO42-,Cl- |
| B、K+,Br-,SO42-,Na+ |
| C、Fe3+,NO3-,Na+,S2- |
| D、I-,Cl-,Mg2+,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 3×10-6 | 7×10-6 | 3×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |


| c(NO2) |
| c(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数为15的元素的最高化合价为+3 |
| B、第ⅦA族元素是同周期中非金属性最强的元素 |
| C、Li、Na、K、Rb、Cs的得电子能力逐渐增强 |
| D、原子序数为12的元素位于元素周期表的第三周期的ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠保存在无水乙醇中 |
| B、冷的浓H2SO4存放于敞口铝制容器中 |
| C、少量的白磷保存在二硫化碳中 |
| D、氯气液化后贮存于钢瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | 实验结论 | 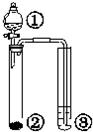 | |
| A | 稀醋酸 | CaCO3 | 澄清石灰水 | 酸性:醋酸>碳酸 | |
| B | 硫酸 | Na2SO3 | 溴水 | SO2具有还原性 | |
| C | 浓盐酸 | KMnO4 | 淀粉KI溶液 | 氧化性:KMnO4>Cl2>I2 | |
| D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com